题目内容
4.实验:①0.1mol/L AgNO3溶液和0.1mol/LNaCl溶液等体积混合得到浊液,过滤.②分别取少量①的滤液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清.③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解.下列分析不正确的是( )| A. | 实验②证明了①的滤液中含有Ag+,由此推断①的滤液中也含有Cl- | |
| B. | 实验②证明了Kap(AgCl)<Kap(Ag2SO4) | |
| C. | 实验③的溶液中含有+微粒 | |
| D. | 由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 |
分析 ①0.1mol/L AgNO3溶液和0.1mol/LNaCl溶液等体积混合得到浊液,产生AgCl沉淀;分别取少量①的滤液,滤液中为饱和的AgCl的溶液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清,前者出现的浑浊应为Ag2S沉淀;取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解,产生了银氨溶液,据此分析解答.
解答 解:A.实验②中向饱和的AgCl溶液中分别加入了等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清,前者出现的沉淀为Ag2S,发生了沉淀的转化,由此证明了证明了①的滤液中含有Ag+,由此推断①的滤液中也含有Cl-.故A正确;
B.实验②中前者产生了Ag2S沉淀,后者没产生Ag2SO4,可见AgCl比Ag2SO4难溶,可以证明Kap(AgCl)<Kap(Ag2SO4).故B正确;
C.实验③中,取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解,反应产生了银氨溶液,因此溶液中含有粒子为$Ag(N{H}_{3})_{2}^{+}$.故C正确;
D.①中的沉淀为AgCl沉淀,实验③时由于加入了氨水,产生了配合物而溶解了沉淀,不是因为碱性.故D错误.
故选D.
点评 本题考察了沉淀的溶解与转化,溶度积常数的简单应用,银氨溶液的制备.需注意,沉淀的转化是一般是转化为更难溶的沉淀.题目难度不大,是基础题.

练习册系列答案
相关题目
11.1molX气体跟amolY气体在体积可变的密闭容器中发生如下反应:X(g)+aY(g)?bZ(g).反应达到平衡后,测得X的转化率为25%.而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的$\frac{5}{6}$,则a和b数值可能是( )
| A. | a=1,b=2 | B. | a=1,b=3 | C. | a=2,b=3 | D. | a=2,b=1 |
9.设NA为阿伏加德罗常数值,下列说法不正确的是( )
| A. | 10 g D216O中所含中子数为5NA | |
| B. | 标准状况下,22.4 L乙烷中所含共价键数目为7NA | |
| C. | 7.8g Na2O2中所含阴、阳离子总数目为0.4NA | |
| D. | 密闭容器中,1 mol N2和3 mol H2充分反应后,容器中的分子数一定大于2NA |
16.4-溴甲基一1-环已烯的一种合成路线如下:
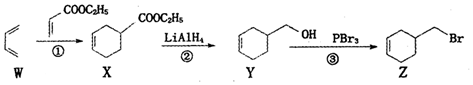
下列说法正确的是( )

下列说法正确的是( )
| A. | 烯烃W名称为1,3-丁二烯,所有原子一定在同一平面上 | |
| B. | ①、②、③的反应类型依次为加成反应、还原反应和取代反应 | |
| C. | 由化合物Z-步制备化合物Y的转化条件是:NaOH醇溶液,加热 | |
| D. | 化合物Y先经酸性髙锰酸鉀溶液氧化,再与乙醇在浓硫酸催化下酯化可得化合物X |
9. 第三代混合动力汽车目前使用的电池是镍氢电池,其工作原理如图所示,其中碳电极内吸附H2,下列说法正确的是( )
第三代混合动力汽车目前使用的电池是镍氢电池,其工作原理如图所示,其中碳电极内吸附H2,下列说法正确的是( )
 第三代混合动力汽车目前使用的电池是镍氢电池,其工作原理如图所示,其中碳电极内吸附H2,下列说法正确的是( )
第三代混合动力汽车目前使用的电池是镍氢电池,其工作原理如图所示,其中碳电极内吸附H2,下列说法正确的是( )| A. | 电键连接b时,碳电极为正极 | |
| B. | 电建连接a时,镍电极反应方程式为Ni(OH)2+OH--e-=NiO(OH)+H2O | |
| C. | 电键连接b时,镍电极周围溶液的pH减小 | |
| D. | 电键连接a时,每转移2mol电子,就有4mol离子通过离子交换膜 |
16.下列分子中,所有原子的最外层均为8电子结构的是( )
| A. | BeCl2 | B. | H2S | C. | CCl4 | D. | BF3 |
13.下列物质反应后出现黄色的是( )
| A. | 淀粉遇碘 | B. | 在新制氢氧化铜中加入葡萄糖溶液 | ||
| C. | 蛋白质与浓硝酸作用 | D. | 乙醇、乙酸和浓硫酸混合加热 |
 正确认识和使用电池有利于我们每一个人的日常生活如图所示装置中:
正确认识和使用电池有利于我们每一个人的日常生活如图所示装置中: