题目内容
14.常温下,向 1L 0.1 mol•L-1的醋酸溶液中加入0.1mol醋酸钠固体,则醋酸的电离平衡向逆(填“正”或“逆”)反应方向移动;溶液中c (CH3COO-)•c(H+)/c (CH3COOH) 的值不变(填“增大”、“减小”或“不变”).分析 醋酸溶液中存在醋酸的电离平衡:CH3COOH?$C{H}_{3}CO{O}^{-}$+H+,其电离平衡常数为Ka=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$,据此作答.
解答 解:常温下,向 1L 0.1 mol/L的醋酸溶液中加入0.1mol醋酸钠固体,加入的醋酸钠能完全电离产生$C{H}_{3}CO{O}^{-}$,相当于增加了溶液中$C{H}_{3}CO{O}^{-}$的浓度,则醋酸的电离平衡向逆反应方向移动;
醋酸的电离平衡常数为Ka=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$,则溶液中$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$的值就是醋酸的电离平衡常数的值,只随温度的改变而改变,因此值不变.
故答案为:逆,不变.
点评 本题主要考察醋酸的电离平衡,化学平衡的移动,电离平衡常数的应用.题目难度不大,是基础题.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
4.实验:①0.1mol/L AgNO3溶液和0.1mol/LNaCl溶液等体积混合得到浊液,过滤.②分别取少量①的滤液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清.③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解.下列分析不正确的是( )
| A. | 实验②证明了①的滤液中含有Ag+,由此推断①的滤液中也含有Cl- | |
| B. | 实验②证明了Kap(AgCl)<Kap(Ag2SO4) | |
| C. | 实验③的溶液中含有+微粒 | |
| D. | 由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 |
5.现有室温下的四种溶液,其pH如下表所示,下列有关叙述不正确是( )
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | ③④中分别加入适量醋酸钠晶体,两溶液pH均增大 | |
| B. | ①与②两溶液中:c(NH4+)>c(Na+) | |
| C. | 分别加水稀释10倍,溶液的pH:①>②>④>③ | |
| D. | V1L①和V2L④溶液混合后,若pH=7,则V1>V2 |
2.有关NaHCO3与Na2CO3的性质,下列叙述中不正确的是( )
| A. | Na2CO3和NaHCO3粉末与同浓度的盐酸反应时,NaHCO3与盐酸反应放出气体速度快 | |
| B. | 等物质的量的两种盐与同浓度的盐酸反应,Na2CO3所消耗盐酸的体积是NaHCO3的两倍 | |
| C. | Na2CO3和NaHCO3溶液分别和BaCl2溶液反应,现象不同 | |
| D. | 要检验NaHCO3固体中是否含Na2CO3,先向试样加水溶解后,再加入足量Ba(OH)2溶液,若有白色沉淀生成,说明NaHCO3固体中含Na2CO3 |
9.5.76g部分氧化的Fe、Cu合金样品(氧化产物为Fe2O3、CuO),经如下处理,下列说法正确的是( )


| A. | V=224 | |
| B. | 样品中Fe的质量为2.14 g | |
| C. | 未氧化前Fe元素的质量分数约为41.2% | |
| D. | 样品中CuO的质量为3.52 g |
19.下列有机物的命名错误的是( )
| A. |  2-乙基-1-丁烯 2-乙基-1-丁烯 | |
| B. |  3-乙基-3-己醇 3-乙基-3-己醇 | |
| C. | (CH3)3CCH(C2H5)CH3 2,2-二甲基-3-乙基丁烷 | |
| D. |  1,3-二溴丙烷 1,3-二溴丙烷 |
3.下列说法正确的是( )
| A. | 淀粉、油脂和蛋白质都是高分子化合物,且它们都是混合物 | |
| B. | 淀粉、纤维素和葡萄糖都能发生水解反应 | |
| C. | 乙醛、乙酸和葡萄糖都能与新制的氢氧化铜悬浊液发生氧化反应 | |
| D. | 氨基酸能够以不同数目和顺序相结合形成结构复杂的多肽 |
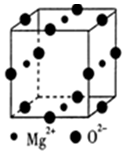 碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.
碱土金属指II A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)等元素,它们的单质及其化合物有着广泛的用途.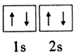 ;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).
;镁和铝的笫二电离能:I2(Mg)<I2(Al) (填“>”“<”或“=”).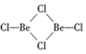 )的形式存在,在1000℃,氯化铍则以BeCl2形式存在.
)的形式存在,在1000℃,氯化铍则以BeCl2形式存在.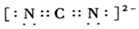 .
.