题目内容
将16mL的NO和NH3的混合气体在催化剂的作用下,400℃左右发生下列反应:6NO+4NH3?5N2+6H2O,已知反应达到平衡后在相同条件下混合气体的体积变为17mL,则在原混合气体中NO和NH3的物质的量之比可能是( )
①3:1 ②3:2 ③3:4 ④3:5.
①3:1 ②3:2 ③3:4 ④3:5.
| A、①② | B、①④ | C、②③ | D、③④ |
考点:化学平衡的计算
专题:化学平衡专题
分析:依据反应前后气体体积增大计算费用的气体体积,气体体积之比等于物质的量之比分析计算原混合气体组成;
解答:
解:6NO+4NH3?5N2+6H2O△v增大
6 4 5 6 1
6ml 4ml 5ml 6 ml (17-16)ml
反应后NO和NH3的混合气体中剩余的气体16ml-6ml-4ml=6ml
若剩余NO则原混合气体中NO体积为6ml+6ml=12ml,NH3的体积4ml,在原混合气体中NO和NH3的物质的量之比=12:4=3:1;
若剩余NH3 则原混合气体中NH3的体积=4ml+6ml=10ml,NO为6ml,在原混合气体中NO和NH3的物质的量之比=6:10=3:5;
故选B.
6 4 5 6 1
6ml 4ml 5ml 6 ml (17-16)ml
反应后NO和NH3的混合气体中剩余的气体16ml-6ml-4ml=6ml
若剩余NO则原混合气体中NO体积为6ml+6ml=12ml,NH3的体积4ml,在原混合气体中NO和NH3的物质的量之比=12:4=3:1;
若剩余NH3 则原混合气体中NH3的体积=4ml+6ml=10ml,NO为6ml,在原混合气体中NO和NH3的物质的量之比=6:10=3:5;
故选B.
点评:本题考查了化学平衡计算应用,注意体积变化的计算分析判断,掌握方法是关键,题目难度中等.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
与50mL 1mol?L-1的AlCl3溶液中氯离子浓度相等的是( )
| A、150mL1mol?L-1的NaCl |
| B、75 mL2mol?L-1的NH4Cl |
| C、25mL 2mol?L-1的KCl |
| D、75 mL1.5mol?L-1的CaCl2 |
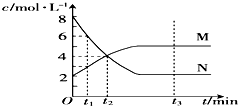 在一定温度下,容器内某一反应中M、N的物质的量浓度随反应时间变化的曲线如图.则下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量浓度随反应时间变化的曲线如图.则下列表述中正确的是( )| A、该反应的化学方程式为2N?M |
| B、t1时,M的浓度是N浓度的2倍 |
| C、t3时,正反应速率大于逆反应速率 |
| D、t2时,正、逆反应速率相等,化学反应达到了平衡 |
下列事实中,不能用勒夏特列原理解释的是( )
| A、Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B、向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
| C、实验室常用排饱和食盐水的方法收集氯气 |
| D、棕红色NO2加压后颜色先变深后变浅 |
下列方法不能用于区分二氧化硫和二氧化碳的是( )
| A、通入品红溶液 |
| B、通入澄清石灰水中 |
| C、通入溴水中 |
| D、通入酸性KMnO4溶液中 |
设NA为阿伏加德罗常数的值.下列说法不正确的是( )
| A、常温下,30 g的2-丙醇中含有羟基的数目为0.5 NA |
| B、15g C2H6含C-H键数目为3NA |
| C、28g乙烯与丙烯的混合气体,含碳原子总数为2NA |
D、7.8g 中含有的碳碳双键数目为0.3NA 中含有的碳碳双键数目为0.3NA |
 请按以下要求,回答下列相应问题:
请按以下要求,回答下列相应问题:
 某温度(t℃)下的溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L,x与y的关系如图所示.
某温度(t℃)下的溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L,x与y的关系如图所示.