题目内容
设NA为阿伏加德罗常数的值.下列说法不正确的是( )
| A、常温下,30 g的2-丙醇中含有羟基的数目为0.5 NA |
| B、15g C2H6含C-H键数目为3NA |
| C、28g乙烯与丙烯的混合气体,含碳原子总数为2NA |
D、7.8g 中含有的碳碳双键数目为0.3NA 中含有的碳碳双键数目为0.3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、根据n=
并结合2-丙醇的结构简式来分析计算;
B、根据n=
并结合C2H6的结构来分析;
C、根据n=
并根据乙烯与丙烯的最简式是CH2来分析;
D、根据苯的结构来分析.
| m |
| M |
B、根据n=
| m |
| M |
C、根据n=
| m |
| M |
D、根据苯的结构来分析.
解答:
解:A、30 g的2-丙醇的物质的量根据n=
=
=0.5mol,根据2-丙醇是一元醇,故含有的羟基的物质的量为0.5mol,个数为0.5 NA,故A正确;
B、15g C2H6的物质的量n=
=
=0.5mol,根据1molC2H6含6molC-H键,故0.5molC2H6含3molC-H键,故个数为3NA,故正确;
C、乙烯与丙烯的最简式是CH2,故28g乙烯与丙烯的混合气体中CH2的物质的量n=
=2mol,故含有的碳原子总数为2NA,故C正确;
D、苯中无碳碳双键,故D错误.
故选D.
| m |
| M |
| 30g |
| 60g/mol |
B、15g C2H6的物质的量n=
| m |
| M |
| 15g |
| 30g/mol |
C、乙烯与丙烯的最简式是CH2,故28g乙烯与丙烯的混合气体中CH2的物质的量n=
| 28g |
| 14g/mol |
D、苯中无碳碳双键,故D错误.
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构是关键,难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
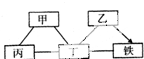 现有铁、氧化铁、稀硫酸、氢氧化钙溶液、碳酸钠溶液等五种物质,存在着如图所示的相互反应或转化关系(图中“一”表示物质间可以发生化学反应,“→”表示物质间存在相应的转化关系).下列判断合理的是( )
现有铁、氧化铁、稀硫酸、氢氧化钙溶液、碳酸钠溶液等五种物质,存在着如图所示的相互反应或转化关系(图中“一”表示物质间可以发生化学反应,“→”表示物质间存在相应的转化关系).下列判断合理的是( )| A、丙可能是碳酸钠溶液 |
| B、丁可能是氢氧化钙溶液 |
| C、乙必须通过置换反应转化为铁 |
| D、甲和丁的反应一定是中和反应 |
向紫色石蕊溶液中加过量的Na2O2粉末,振荡,正确的叙述是( )
| A、溶液仍为紫色 |
| B、最后溶液变为蓝色且有气泡产生 |
| C、最后溶液退色 |
| D、振荡后向其中加入FeCl2溶液一定不会出现红褐色沉淀 |
下列关说法中,正确的是( )
| A、物质的量就是物质的数量 |
| B、摩尔是一个物理量 |
| C、摩尔是物质的量的单位 |
| D、摩尔是数的一种很大的单位 |
将16mL的NO和NH3的混合气体在催化剂的作用下,400℃左右发生下列反应:6NO+4NH3?5N2+6H2O,已知反应达到平衡后在相同条件下混合气体的体积变为17mL,则在原混合气体中NO和NH3的物质的量之比可能是( )
①3:1 ②3:2 ③3:4 ④3:5.
①3:1 ②3:2 ③3:4 ④3:5.
| A、①② | B、①④ | C、②③ | D、③④ |
下列化合物中含有手性碳原子的是( )
| A、CCl2F2 |
B、 |
| C、CH3CH2OH |
D、 |