题目内容
 请按以下要求,回答下列相应问题:
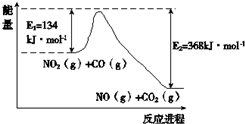
请按以下要求,回答下列相应问题:(1)根据下面的能量变化示意图1:
写出CO和NO2反应生成NO和CO2的热化学方程式
(2)在锌与某浓度的盐酸反应的实验中,一个学生得到下表所示的结果.
| 序号 | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶解于酸的时间/s |
| 1 | 2 | 薄片 | 5 | 400 |
| 2 | 2 | 颗粒 | 5 | 500 |
| 3 | 2 | 薄片 | 15 | 200 |
| 4 | 2 | 薄片 | 25 | 100 |
| 5 | 2 | 薄片 | 35 | 50 |
| 6 | 2 | 颗粒 | 15 | t1 |
| 7 | 2 | 粉末 | 15 | t2 |
②本实验中影响反应速率的其它因素还有
③以上数据说明,在实验条件下温度对反应速率影响的半定量的经验规律为
(3)固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3 (g)△H<0,其平衡常数K与温度T的关系如下表,试判断K1
| T/K | 298 | 398 |
| 平衡常数K | K1 | K2 |
a.v(H2)正=3v(N2)逆 b.容器内压强保持不变
c.容器中混合气体的密度保持不变 d.N2、H2、NH3的浓度之比为1:3:2.
考点:化学平衡建立的过程,用盖斯定律进行有关反应热的计算,化学平衡的影响因素,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)根据图1可知反应热△H=E1-E2=134kJ?mol-1-368kJ?mol-1=-234 kJ?mol-1,热化学方程式为CO(g)+NO2 (g)═CO2(g)+NO (g)△H=-234 kJ?mol-1;
(2)①根据题目中表格可知,锌的形状相同,温度不同时,就是表明温度对反应速率产生影响;
②根据表中提供的数据可知,锌的形状对反应速率也有影响,也就是表面积的影响;颗粒越上,表面积越大,反应速率越大,反应时间越短,比较实验3、6和比较实验3、7可判断出t1、t2的大小;
③比较3、4、5三个实验可以知道,每升高10℃,反应时间缩短为原来的一半,据此答题;
(3)该反应为放热反应,温度升高,平衡逆向移动,平衡常数减小,据此答题;
(4)根据化学平衡状态的特征作判断.
(2)①根据题目中表格可知,锌的形状相同,温度不同时,就是表明温度对反应速率产生影响;
②根据表中提供的数据可知,锌的形状对反应速率也有影响,也就是表面积的影响;颗粒越上,表面积越大,反应速率越大,反应时间越短,比较实验3、6和比较实验3、7可判断出t1、t2的大小;
③比较3、4、5三个实验可以知道,每升高10℃,反应时间缩短为原来的一半,据此答题;
(3)该反应为放热反应,温度升高,平衡逆向移动,平衡常数减小,据此答题;
(4)根据化学平衡状态的特征作判断.
解答:
解:(1)根据图1可知反应热△H=E1-E2=134kJ?mol-1-368kJ?mol-1=-234 kJ?mol-1,热化学方程式为CO(g)+NO2 (g)═CO2(g)+NO (g)△H=-234 kJ?mol-1,
故答案为:CO(g)+NO2 (g)═CO2(g)+NO (g)△H=-234 kJ?mol-1;
(2)①根据题目中表格可知,实验4、5锌的形状相同,温度不同时,就是表明温度对反应速率产生影响,故答案为:4、5;
②根据表中提供的数据可知,锌的形状对反应速率也有影响,也就是表面积的影响;颗粒越上,表面积越大,反应速率越大,反应时间越短,比较实验3、6和比较实验3、7可判断出t1>200℃、t2<200℃,故答案为:表面积;200;
③比较3、4、5三个实验可以知道,每升高10℃,反应时间缩短为原来的一半,故答案为:温度每升高10℃,反应速率加快一倍;
(3)该反应为放热反应,温度升高,平衡逆向移动,平衡常数减小,所以K1>K2,故答案为:>;
(4)a.v(H2)正=3v(N2)逆,根据反应速率之比等于计量数之比,说明可逆反应的正逆反应速率相等,反应处于平衡状态,故a正确;
b.因为该反应是气体体积减小的反应,所以当容器内压强保持不变时,说明反应已经处于平衡状态,故b正确;
c.该反应在恒容条件下进行,反应前后气体质量守恒,所以容器中混合气体的密度始终保持不变,故密度不变不能说明反应是否处于平衡状态,故c错误;
d.N2、H2、NH3的浓度之比为与起始投入的物料有关,不能说明反应是否处于平衡状态,故d错误;
故选ab.
故答案为:CO(g)+NO2 (g)═CO2(g)+NO (g)△H=-234 kJ?mol-1;
(2)①根据题目中表格可知,实验4、5锌的形状相同,温度不同时,就是表明温度对反应速率产生影响,故答案为:4、5;
②根据表中提供的数据可知,锌的形状对反应速率也有影响,也就是表面积的影响;颗粒越上,表面积越大,反应速率越大,反应时间越短,比较实验3、6和比较实验3、7可判断出t1>200℃、t2<200℃,故答案为:表面积;200;
③比较3、4、5三个实验可以知道,每升高10℃,反应时间缩短为原来的一半,故答案为:温度每升高10℃,反应速率加快一倍;
(3)该反应为放热反应,温度升高,平衡逆向移动,平衡常数减小,所以K1>K2,故答案为:>;
(4)a.v(H2)正=3v(N2)逆,根据反应速率之比等于计量数之比,说明可逆反应的正逆反应速率相等,反应处于平衡状态,故a正确;
b.因为该反应是气体体积减小的反应,所以当容器内压强保持不变时,说明反应已经处于平衡状态,故b正确;
c.该反应在恒容条件下进行,反应前后气体质量守恒,所以容器中混合气体的密度始终保持不变,故密度不变不能说明反应是否处于平衡状态,故c错误;
d.N2、H2、NH3的浓度之比为与起始投入的物料有关,不能说明反应是否处于平衡状态,故d错误;
故选ab.
点评:本题主要考查了热化学方程式、影响化学反应速率的因素、影响化学平衡常数的因素、平衡状态的判断等知识点,难度不大,解题时注意化学实验思维的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
现有一包铝热剂是铝粉和氧化铁(Fe2O3)粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(假定反应前后溶液的体积不变):
①向其中一份固体中加入100mL 2.0mol?L-1的NaOH溶液,加热使其充分反应后过滤,测得溶液中的c(OH-)=1mol?L-1
②向另一份固体中加入100mL 4.0mol?L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且c(H+)=0.1mol?L-1 ,则产生的气体的体积(标准状况)为( )
①向其中一份固体中加入100mL 2.0mol?L-1的NaOH溶液,加热使其充分反应后过滤,测得溶液中的c(OH-)=1mol?L-1
②向另一份固体中加入100mL 4.0mol?L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且c(H+)=0.1mol?L-1 ,则产生的气体的体积(标准状况)为( )
| A、2.856L |
| B、2.448L |
| C、2.688L |
| D、2.352L |
常温下将10ml PH=13的Ba(OH)2溶液加水稀释至100ml,所得溶液的PH为( )
| A、14 | B、12.7 |
| C、12 | D、10 |
将16mL的NO和NH3的混合气体在催化剂的作用下,400℃左右发生下列反应:6NO+4NH3?5N2+6H2O,已知反应达到平衡后在相同条件下混合气体的体积变为17mL,则在原混合气体中NO和NH3的物质的量之比可能是( )
①3:1 ②3:2 ③3:4 ④3:5.
①3:1 ②3:2 ③3:4 ④3:5.
| A、①② | B、①④ | C、②③ | D、③④ |
下列说法正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、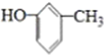 的名称为:对甲基苯酚 的名称为:对甲基苯酚 |
| C、CH2Cl2与C2H6O都存在同分异构体 |
| D、乙酸的分子式:C2H4O2 |
