��Ŀ����
��ͭ����Ҫ�ɷ�CuFeS2������ȡͭ����Ҫԭ��
��1��ȡ12.5g��ͭ����Ʒ�����ⶨ��3.60g�����ʲ�����������CuFeS2����Ϊ ��
��2����֪2CuFeS2+4O2
Cu2S+3SO2+2FeO��¯����������Cu2S��1200������¼�����Ӧ��
2Cu2S+3O2
2Cu2O+2SO2��2Cu2O+Cu2S
6Cu+SO2
�ٶ�������Ӧ����ȫ��������м��㣺
����6mol CuFeS2����6mol Cu��������O2�����ʵ�����
��6mol CuFeS2��14.25mol O2��Ӧ�������Ͽɵõ�����Ħ��ͭ��
��6mol CuFeS2��15.75mol O2��Ӧ�������Ͽɵõ�����Ħ��ͭ��
��1��ȡ12.5g��ͭ����Ʒ�����ⶨ��3.60g�����ʲ�����������CuFeS2����Ϊ
��2����֪2CuFeS2+4O2
| ||
2Cu2S+3O2
| ||
| ||
�ٶ�������Ӧ����ȫ��������м��㣺
����6mol CuFeS2����6mol Cu��������O2�����ʵ�����
��6mol CuFeS2��14.25mol O2��Ӧ�������Ͽɵõ�����Ħ��ͭ��
��6mol CuFeS2��15.75mol O2��Ӧ�������Ͽɵõ�����Ħ��ͭ��
���㣺������ԭ��Ӧ�ļ���
ר�⣺
��������1��m����Ʒ�����أ�CuFeS2����CuFeS2��SԪ�ص���������=m��S����
��2�����ɷ�Ӧ��֪������CuFeS2��O2��Ӧ�����ճ�ΪFeO��Cu��SO2������ԭ���غ����n��FeO����n��SO2��������Oԭ���غ��֪2n��O2��=n��FeO��+n��SO2����
�ڢ۸��ݷ���ʽ����6mol CuFeS2����O2�����ʵ���������Cu2S�����ʵ�������������ʣ��O2�����ʵ���������2Cu2S+3O2=2Cu2O+2SO2���㷴Ӧ��Cu2S�����ʵ���������Cu2O�����ʵ�������������ʣ��Cu2S�����ʵ������ٸ���2Cu2O+Cu2S��6Cu+SO2���й������㣮
��2�����ɷ�Ӧ��֪������CuFeS2��O2��Ӧ�����ճ�ΪFeO��Cu��SO2������ԭ���غ����n��FeO����n��SO2��������Oԭ���غ��֪2n��O2��=n��FeO��+n��SO2����
�ڢ۸��ݷ���ʽ����6mol CuFeS2����O2�����ʵ���������Cu2S�����ʵ�������������ʣ��O2�����ʵ���������2Cu2S+3O2=2Cu2O+2SO2���㷴Ӧ��Cu2S�����ʵ���������Cu2O�����ʵ�������������ʣ��Cu2S�����ʵ������ٸ���2Cu2O+Cu2S��6Cu+SO2���й������㣮
���
�⣺��1��12.5g���أ�CuFeS2����
=3.6g����æأ�CuFeS2��=82.8%���ʴ�Ϊ��82.8%��
��2�����ɷ�Ӧ��֪������CuFeS2��O2��Ӧ�����ճ�ΪFeO��Cu��SO2������ԭ���غ�n��FeO��=n��CuFeS2��=6mol��n��SO2��=2n��CuFeS2��=mol������Oԭ���غ��֪2n��O2��=n��FeO��+2n��SO2��=6mol+12mol��2����n��O2��=15mol��
������O2�����ʵ���Ϊ15mol��
��2CuFeS2+4O2=Cu2S+3SO2+2FeO��6mol 12mol 3mol
��ʣ������Ϊ14.25mol-12mol=2.25mol������Cu2SΪ3mol��
2Cu2S+3O2=2Cu2O+2SO2��
3mol 4.5mol
���������㣬��������ȫ��Ӧ������Cu2OΪ2.25mol��
=1.5mol��ʣ��Cu2SΪ3mol-1.5mol=1.5mol��
2Cu2O+Cu2S=6Cu+SO2��
1.5mol 0.75mol
��������ͭ��ȫ��Ӧ������ͭ1.5mol��
=4.5mol��
�������Ͽɵõ�4.5molCu��
��2CuFeS2+4O2=Cu2S+3SO2+2FeO
6mol 12mol 3mol
��ʣ������Ϊ15.75mol-12mol=3.75mol������Cu2SΪ3mol��
2Cu2S+3O2=2Cu2O+2SO2��
3mol 4.5mol
���������㣬��������ȫ��Ӧ������Cu2OΪ3.75mol��
=2.5mol��ʣ��Cu2SΪ3mol-2.5mol=0.5mol��
2Cu2O+Cu2S=6Cu+SO2��
1mol 0.5mol
��������ͭ��ʣ�࣬����ͭ0.5mol��6=3mol��
�������Ͽɵõ�ͭ3mol��
| 64 |
| 64+56+64 |
��2�����ɷ�Ӧ��֪������CuFeS2��O2��Ӧ�����ճ�ΪFeO��Cu��SO2������ԭ���غ�n��FeO��=n��CuFeS2��=6mol��n��SO2��=2n��CuFeS2��=mol������Oԭ���غ��֪2n��O2��=n��FeO��+2n��SO2��=6mol+12mol��2����n��O2��=15mol��
������O2�����ʵ���Ϊ15mol��
��2CuFeS2+4O2=Cu2S+3SO2+2FeO��6mol 12mol 3mol
��ʣ������Ϊ14.25mol-12mol=2.25mol������Cu2SΪ3mol��
2Cu2S+3O2=2Cu2O+2SO2��
3mol 4.5mol
���������㣬��������ȫ��Ӧ������Cu2OΪ2.25mol��
| 2 |
| 3 |
2Cu2O+Cu2S=6Cu+SO2��
1.5mol 0.75mol
��������ͭ��ȫ��Ӧ������ͭ1.5mol��
| 6 |
| 2 |
�������Ͽɵõ�4.5molCu��
��2CuFeS2+4O2=Cu2S+3SO2+2FeO
6mol 12mol 3mol
��ʣ������Ϊ15.75mol-12mol=3.75mol������Cu2SΪ3mol��
2Cu2S+3O2=2Cu2O+2SO2��
3mol 4.5mol
���������㣬��������ȫ��Ӧ������Cu2OΪ3.75mol��
| 2 |
| 3 |
2Cu2O+Cu2S=6Cu+SO2��
1mol 0.5mol
��������ͭ��ʣ�࣬����ͭ0.5mol��6=3mol��
�������Ͽɵõ�ͭ3mol��
���������⿼��������йؼ��㣬��Ŀ���̸��ӣ��������ܴ�Ϊ�״���Ŀ����ѧ�������������нϸߵ�Ҫ��ע��ԭ���غ������������㣮

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
����ʱ����pH=2��CH3COOH��Һ�� ��pH=2��HCl��Һ�� ��pH=12�İ�ˮ����pH=12��NaOH��Һ����ͬ�����£��й�������Һ�ıȽ��У�����ȷ���ǣ�������
| A����ˮ�����c��H+������=��=��=�� |
| B��������Ģ١��ڡ�����Һ�ֱ����������۷�Ӧ������H2����������� |
| C�����ڡ�����Һ��Ϻ���pH=7����������Һ��������ڣ��� |
| D��������Һ��ϡ��100������Һ��pH���ۣ��ܣ��ڣ��� |
һ��������ֲ���������ڼ������ʣ��ṹ��ͼ��ʾ������˵����ȷ���ǣ�������
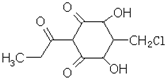

| A�������ʵķ���ʽΪ��C10H7O5Cl |
| B��1mol�������ڳ�����������3mol NaOH��Ӧ |
| C����������FeCl3��Һ���ܷ�����ɫ��Ӧ |
| D�������ʿɷ���ȡ������������ȥ��Ӧ |
��0.02mol Na��Ͷ�뵽ʢ��100mLˮ��100mL 1mol?L-1���ᡢ100mL 1mol?L-1����ͭ��Һ��X��Y��Z�����ձ��У������й�˵��������ǣ�������
| A�������ձ���һ�����ᷢ�������ӷ�Ӧ�У�2Na+2H2O�T2Na++2OH-+H2�� |
| B�������ձ����ƾ���Һ���Ͼ��ҷ�Ӧ����ȶ��ԣ�X�ձ��еķ�Ӧƽ��Щ |
| C��Z�ձ���һ�����г������ɣ����������ǵ���ͭ |
| D�������ձ�����������������ʵ�����ͬ |
�ֹ����չ����У����й�������Ҥ¯����ɵ��ǣ�������
| A���ս� | B����� | C������ | D������ |
��֪��Ӧ��CO��g��+H2O��g���TCO2��g��+H2��g����H=-41kJ?mol-1��2H2��g��+O2��g���T2H2O��g����H=-484kJ?mol-1��������˵������ȷ���ǣ�������
| A��COת��ΪCO2���Ȼ�ѧ����ʽΪ2CO��g��+O2��g���T2CO2��g����H=-566 kJ?mol-1 | ||
B��COȼ���ȵ��Ȼ�ѧ����ʽΪCO��g��+
| ||
| C�����ȷ�Ӧ������Ҫ���Ȳ��ܽ��У������ȷ�Ӧһ����Ҫ���Ȳ��ܽ��� | ||
| D��1mol H2��ȫȼ������1mol Һ̬ˮ���ų�����������242 kJ |
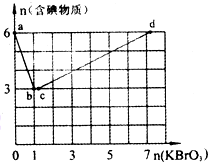 ����6 mol KI��������Һ����μ���KBrO3��Һ�����������к������ʵ����ʵ�����������KBrO3�����ʵ����Ĺ�ϵ��ͼ��ʾ����ش��������⣺
����6 mol KI��������Һ����μ���KBrO3��Һ�����������к������ʵ����ʵ�����������KBrO3�����ʵ����Ĺ�ϵ��ͼ��ʾ����ش��������⣺