题目内容
18.下列描述中正确的是( )| A. | HCN为V形分子 | |
| B. | NO3-的空间构型为三角锥形 | |
| C. | SF6中有6对完全相同的成键电子对 | |
| D. | SO42-和SO32-的中心原子均为sp3杂化 |
分析 A.HCN的结构为H-C≡N,C原子没有孤电子对;
B.根据价层电子对个数=σ键个数+孤电子对个数计算判断;
C.根据SF6中S原子的成键电子对数和孤电子对数判断;
D.先判断价层电子对数再判断杂化类型.
解答 解:A.HCN的结构为H-C≡N,C原子没有孤电子对,为直线形,故A错误;
B.NO3-中N原子的价层电子对数=3+$\frac{1}{2}$(5+1-2×3)=3,为sp2杂化,没有孤电子对,所以平面三角形,故B错误;
C.SF6中S的价层电子对数=6+$\frac{1}{2}$(6+6×1)=6,没有孤电子对,所以SF6中有6对完全相同的成键电子对,故C正确;
D.SO42-中S的价层电子对数=4+$\frac{1}{2}$(6+2-4×2)=4,为sp3杂化,SO32-的价层电子对数=3+$\frac{1}{2}$(6+2-4×2)=3,为sp2杂化,故D错误.
故选C.
点评 本题考查了微粒空间构型的判断,利用价层电子对互斥理论分析解答即可,难点是孤电子对的计算方法,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列措施或事实不能用勒沙特列原理解释的是( )
| A. | 新制的氯水在光照下颜色变浅 | |
| B. | NO2和N2O4平衡混合气缩小体积加压后颜色变深 | |
| C. | 硫酸工业上SO2氧化成SO3,宜采用空气过量 | |
| D. | 煅烧硫铁矿利于SO2的生成 |
10.下列有关物质的性质与其应用不相对应的是( )
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮藏贮运浓硫酸 | |
| B. | 氯气具有强氧化性,因此可用于漂白有色布料 | |
| C. | NH3能与Cl2生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏 | |
| D. | 氢氟酸能与二氧化硅反应,因此可用于刻蚀玻璃 |
7.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气产生的速率.
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10
②反应一段时间后,实验E中的金属呈红色.
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)上述实验中发生反应的化学方程式有Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气产生的速率.
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 混合液 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②反应一段时间后,实验E中的金属呈红色.
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.

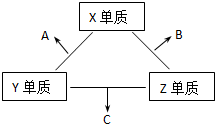 X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化: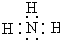 ,C分子的结构呈三角锥形.
,C分子的结构呈三角锥形.