题目内容
16.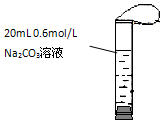 如图,将2mL浓度为6mol/L的盐酸用注射器通过橡皮塞慢慢注入,玻璃管中出现小气泡,气泡在溶液中逐渐上升的过程中消失.对该反应过程的推断不合理的是:( )
如图,将2mL浓度为6mol/L的盐酸用注射器通过橡皮塞慢慢注入,玻璃管中出现小气泡,气泡在溶液中逐渐上升的过程中消失.对该反应过程的推断不合理的是:( )| A. | 有反应CO32-+2H+→CO2↑+H2O | |
| B. | 有反应CO32-+H+→HCO3-发生 | |
| C. | 有反应CO32-+CO2+H2O→2HCO3-发生 | |
| D. | 加快盐酸注入速度不会改变反应现象 |
分析 盐酸用注射器通过橡皮塞慢慢注入,盐酸不足先发生CO32-+H+=HCO3-,后发生HCO3-+H+=CO2↑+H2O,气泡在溶液中逐渐上升的过程中消失,则发生CO32-+CO2+H2O=2HCO3-;
若盐酸过程,则一步完成CO32-+2H+=CO2↑+H2O,现象不同,以此来解答.
解答 解:A.盐酸不足时发生反应:CO32-+H+=HCO3-,后发生HCO3-+H+=CO2↑+H2O,总反应为CO32-+2H+=CO2↑+H2O,故A正确;
B.盐酸慢慢注入,盐酸不足时发生反应:CO32-+H+=HCO3-,故B正确;
C.气泡在溶液中逐渐上升的过程中消失,则发生反应:CO32-+CO2+H2O=2HCO3-,故C正确;
D.加快盐酸注入速率,若盐酸过量,很快观察到气泡冒出,则反应现象不同,故D错误;
故选D.
点评 本题考查盐酸与碳酸钠的反应,把握量对反应的影响及发生的不同化学反应为解答的关键,注意二者量不同,反应不同,所以现象不同,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| B. | 常温常压下,1molNO2气体与水完全反应,转移电子数为NA | |
| C. | 标准状况下,11.2LC2H5OH中所含的分子数为0.5NA | |
| D. | 常温常压下,17gNH3中含有的共用电子对数为4NA |
7.下列有关Cl、N、S等非金属元素化合物的说法正确的是( )
| A. | 漂白粉是纯净物,其成分就是次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理SO2和HCl废气 | |
| D. | 浓盐酸、浓硫酸、浓硝酸都有强氧化性,能氧化金属铜 |
4.下列现象或应用不能用胶体的知识解释的是( )
| A. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 | |
| B. | 氯化钙溶液中加入碳酸钠溶液会出现白色沉淀 | |
| C. | 水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染 | |
| D. | 江河入海口形成三角州 |
11.下列离子方程式中书写正确的是( )
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl- | |
| B. | H2S通入CuSO4溶液中:Cu2++S2-→CuS↓ | |
| C. | FeS固体放人稀盐酸溶液中:FeS+2H+→Fe2++H2S↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-→AlO2-+2H2O |
1.下列物质中属于离子化合物的是( )
| A. | 苛性钠 | B. | 碘化氢 | C. | 硫酸 | D. | 硝酸 |
8.砹是核电荷数最大的卤族元素,推断砹及砹的化合物不可能具有的性质是( )
①HAt很稳定
②砹易溶于某些有机溶剂
③砹的熔沸点较高
④砹是有色固体
⑤砹化银不溶于水
⑥砹在水中溶解度较小.
①HAt很稳定
②砹易溶于某些有机溶剂
③砹的熔沸点较高
④砹是有色固体
⑤砹化银不溶于水
⑥砹在水中溶解度较小.
| A. | 只有① | B. | 只有①② | C. | 只有③④⑤ | D. | 只有②④⑤ |
6.下列化学方程式中,能用离子方程式H++OH-→H2O表示的是( )
| A. | 2H2+O2 $\stackrel{点燃}{→}$2H2O | B. | 2HCl+Ba(OH)2→2BaCl2+H2O | ||
| C. | H2SO4+Cu(OH)2→CuSO4+2H2O | D. | Ba(OH)2+H2SO4→BaSO4↓+2H2O |