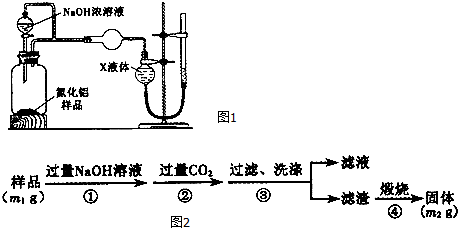
题目内容
11.下列装置或操作正确,且能达到目的是( )| A. | 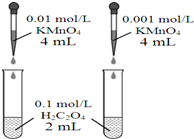 依据褪色快慢比较浓度对反应速率的影响 | |
| B. | 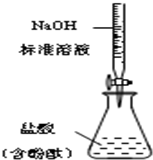 测定盐酸浓度 | |
| C. | 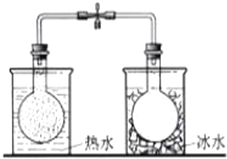 依据气体颜色变化,证明温度对平衡移动的影响 | |
| D. | 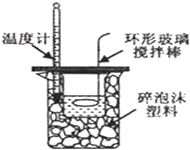 中和热的测定 |
分析 A.两种高锰酸钾的浓度不同,颜色本来就不同,不符合控制变量法;
B.中和滴定时,NaOH溶液应该盛放在碱式滴定管中;
C.N2O4是红棕色气体,放入热水中,平衡逆向移动,放入冷水中平衡正向移动;
D.中和热的测定中,温度计测量混合溶液温度.
解答 解:A.两种高锰酸钾的浓度不同,颜色不同,不符合控制变量法,应保证高锰酸钾浓度相同,用不同浓度的草酸来做实验,故A错误;
B.中和滴定时,NaOH溶液应该盛放在碱式滴定管中,该实验盛放氢氧化钠溶液的滴定管是酸式滴定管,故B错误;
C.N2O4是红棕色气体,放入热水中,平衡逆向移动,放入冷水中平衡正向移动,所以依据气体颜色变化,证明温度对平衡移动的影响,故C正确;
D.中和热的测定中,温度计测量混合溶液温度,该操作错误,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及中和热的测定、仪器使用、化学平衡影响因素判断等知识点,明确实验原理及操作规范性是解本题关键,易错选项是A.

练习册系列答案
相关题目
1.在无色透明溶液中可以大量共存的离子组是( )
| A. | H+ Na+ S2- CO32- | B. | H+ Ca2+ MnO${\;}_{4}^{-}$ NO${\;}_{3}^{-}$ | ||
| C. | K+ Ca2+ Cl- HCO${\;}_{3}^{-}$ | D. | Cl- Mg2+ Al3+ OH- |
2.NA表示阿伏加德罗常数,则下列说法正确的是( )
| A. | 22.4LCO中一定含有6.02×1023个分子 | |
| B. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA | |
| C. | 常温常压下,16gO2与16gO3含有的分了数相同 | |
| D. | 0.1mol/LK2SO4溶液中含有K+为0.2NA |
6.已知24mL浓度为0.05mol/L 的Na2SO3溶液恰好与V mL浓度为0.02mol/L的K2Cr2O7溶液完全反应;又知Na2SO3被K2Cr2O7氧化为Na2SO4,元素Cr在还原产物中的化合价为+3价,则所需K2Cr2O7溶液体积V为( )
| A. | 10 | B. | 20 | C. | 30 | D. | 40 |
3.在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况,下列反应中属于这种情况的是( )
①过量的锌与浓硫酸反应;②过量的氢气与少量的N2在工业生产条件下反应;③过量的浓盐酸与碳酸钙反应;④过量二氧化锰与浓盐酸在加热条件下反应;⑤过量的铜与浓硫酸在加热条件下反应.
①过量的锌与浓硫酸反应;②过量的氢气与少量的N2在工业生产条件下反应;③过量的浓盐酸与碳酸钙反应;④过量二氧化锰与浓盐酸在加热条件下反应;⑤过量的铜与浓硫酸在加热条件下反应.
| A. | ②③④ | B. | ②④⑤ | C. | ①②④ | D. | ③④⑤ |
1. 25℃时,氢氟酸的电离常数Ka=6.8×10-4mol•L-1,醋酸的电离常数Ka=1.8×10-5mol•L-1,如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系,则Y可以表示( )
25℃时,氢氟酸的电离常数Ka=6.8×10-4mol•L-1,醋酸的电离常数Ka=1.8×10-5mol•L-1,如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系,则Y可以表示( )
 25℃时,氢氟酸的电离常数Ka=6.8×10-4mol•L-1,醋酸的电离常数Ka=1.8×10-5mol•L-1,如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系,则Y可以表示( )
25℃时,氢氟酸的电离常数Ka=6.8×10-4mol•L-1,醋酸的电离常数Ka=1.8×10-5mol•L-1,如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系,则Y可以表示( )| A. | 溶液的pH | B. | 水解平衡常数 | ||
| C. | 水解百分率 | D. | 溶液中阴离子浓度之和 |
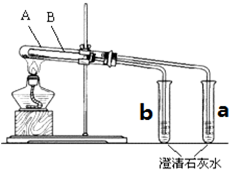 为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.
为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.