题目内容
16.某氮化铝(AlN)样品仅含有Al2O3杂质,某学习小组为测定该氮化铝样品中A1N的纯度,设计如下2种方案 (查阅资料得知:AIN+NaOH+3H2O═Na[Al(OH)4]+NH3↑).方案一:量气法--如图1所示.
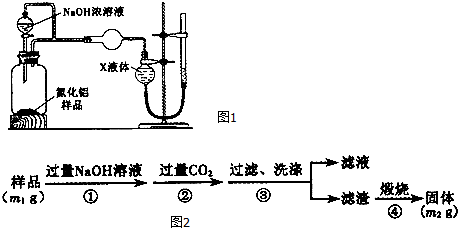
(1)按图连接好装置,检查装置气密性的方法是往量气管中注水至左右两管出现液面差,静置片刻,液面差不发生变化,则气密性良好.
(2)导管a的主要作用是:①消除由于NaOH溶液的加入引起的所测气体体积不准确;②平衡分液漏斗上方与广口瓶内压强,使液体容易滴下.
(3)为测定生成气体的体积,量气装置中的X液体可以是AD(填标号).
A.CCl4B.H2OC.NH4C1溶液D.植物油
(4)若取m g样品与NaOH浓溶液完全反应后,测得生成气体的体积为V mL(标准状况).则样品中A1N的纯度为$\frac{41V}{22400m}$×100%.
方案二:重量法--如图2所示.
(5)步骤②反应的离子方程式为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓.
(6)若准确称取m1g样品,实验测得样品中A1N的纯度偏高,可能的原因是沉淀洗涤不干净(或称量样品的质量偏大或氢氧化铝灼烧不完全或其它合理答案)(写1点).
分析 方案1(1)气密性检查的方法是,在使所要检查的实验系统密封的条件下,通过一定方法,如改变温度,往系统内加水,或通入气体等,改变系统内的压强,导致系统内外压强不同,然后观察现象;
(2)导气管a联通分液漏斗上方和广口瓶,可使上下压强一致;
(3)依据氨气极易溶于水的性质分析判断;
(4)依据化学方程式定量关系计算得到;
方案二 样品和氢氧化钠反应生成偏铝酸钠含氨气,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,对沉淀洗涤、灼烧得到氧化铝,m2g为氧化铝的质量.
(5)步骤②是偏铝酸钠溶液中通入过量二氧化碳气体反应生成氢氧化铝和碳酸氢钠;
(6)沉淀不洗涤得到滤渣质量会增大,测定结果会偏高.
解答 解:(1)此装置可采取往系统中加水,使内外压强不同通过形成液面差不变说明气密性良好,
故答案为:往量气管中注水至左右两管出现液面差,静置片刻,液面差不发生变化,则气密性良好;
(2)导气管a联通分液漏斗上方和广口瓶,可使上下压强一致,所以平衡分液漏斗上方与广口瓶内压强,使液体容易滴下;
故答案为:平衡分液漏斗上方与广口瓶内压强,使液体容易滴下;
(3)氨气极易溶于水,为测定生成气体的体积,量气装置中的X液体不能溶解氨气或与氨气反应,则
A.CCl4不能溶解氨气,可以用排四氯化碳溶液的方法测定氨气体积,故A正确;
B.氨气极易溶于水,不能排水法测定,故B错误;
C.氨气极易溶于水,不能用排NH4Cl溶液的方法测定气体体积,故C错误;
D.氨气不溶于植物油,可以利用排植物油方法,测定氨气的体积,故D正确;
故选AD;
(4)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),设氮化铝纯度为x,
AlN+NaOH+H2O═NaAlO2+NH3↑
41g 22.4L
mxg V×10-3L
x=$\frac{41V×10{\;}^{-3}}{22.4m}$×100%=$\frac{41V}{22400m}$×100%,
故答案为:$\frac{41V}{22400m}$×100%;
(5)步骤②是偏铝酸钠溶液中通入过量二氧化碳气体反应生成氢氧化铝和碳酸氢钠,反应的离子方程式为CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,
故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(6)若在步骤③中未洗涤,沉淀不洗涤得到滤渣质量会增大,测定结果会偏高,氢氧化铝灼烧不完全,导致m2偏大,测定结果偏高等,
故答案为:沉淀洗涤不干净(或称量样品的质量偏大或氢氧化铝灼烧不完全或其它合理答案).
点评 此题是实验和利用化学方程式计算相结合的题目,难度中等,该题步骤较多,应认真分析,另外要掌握关系法、差量法的应用.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | 向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO42- | |
| B. | 某溶液能使淀粉碘化钾溶液变蓝,则该溶液一定为氯水或者溴水 | |
| C. | 向某白色固体粉末中滴加稀盐酸,产生能使澄清石灰水变浑浊的气体,则原固体粉末中一定含CO32-或HCO3- | |
| D. | 将某白色固体粉末与氢氧化钠浓溶液共热,产生能使湿润的红色石蕊试纸变蓝的气体,证明原固体中一定含有NH4+ |

| A. | 稀释前,c (A)>10 c (B) | |
| B. | 稀释前,A溶液中水电离出的OH- 浓度是B溶液中由水电离出的OH- 浓度的10倍 | |
| C. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 | |
| D. | M点时A和B的浓度相等 |
| A. | 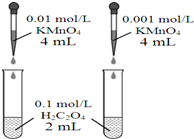 依据褪色快慢比较浓度对反应速率的影响 | |
| B. | 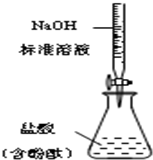 测定盐酸浓度 | |
| C. | 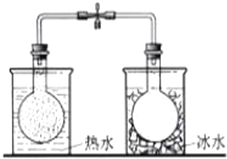 依据气体颜色变化,证明温度对平衡移动的影响 | |
| D. | 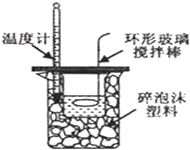 中和热的测定 |
| A. | FeCl3和NaHCO3的固体混合物,加热时有气体产生,加水溶解时有沉淀生成. | |
| B. | 25℃与60℃时,水的pH相等 | |
| C. | 中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)不相等 | |
| D. | 2SO2(g)+O2(g)═2SO3(g)和 4SO2(g)+2O2(g)=4SO3(g)的△H相等 |
| A. | NaHRO3溶液中(R表示S或C):c(Na+)>c(HRO3-)>c(OH-)>c(H+)>c(RO32-) | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后呈中性,则混合溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② | |
| D. | 等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数:N前>N后 |
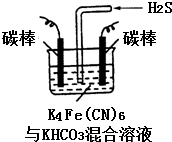 铁及其化合物在日常生活中应用广泛.
铁及其化合物在日常生活中应用广泛.
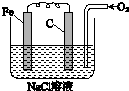 金属腐蚀的电化学原理可用如图模拟.
金属腐蚀的电化学原理可用如图模拟.