题目内容
6.已知24mL浓度为0.05mol/L 的Na2SO3溶液恰好与V mL浓度为0.02mol/L的K2Cr2O7溶液完全反应;又知Na2SO3被K2Cr2O7氧化为Na2SO4,元素Cr在还原产物中的化合价为+3价,则所需K2Cr2O7溶液体积V为( )| A. | 10 | B. | 20 | C. | 30 | D. | 40 |
分析 Na2SO3被氧化为Na2SO4,S元素化合价由+4价升高为+6价,K2Cr2O7中Cr元素发生还原反应,由+7价降低为+3,令K2Cr2O7溶液的体积为V,表示出消耗K2Cr2O7的物质的量,再根据电子转移守恒计算.
解答 解:Na2SO3被氧化为Na2SO4,S元素化合价由+4价升高为+6价;K2Cr2O7中Cr元素发生还原反应,由+7价降低为+3,
令K2Cr2O7溶液的体积为V,根据电子转移守恒,则:
24×10-3L×0.05mol/L×(6-4)=V×0.02mol/L×2×(6-3)
解得V=0.02L,即为20mL,
故选B.
点评 本题考查氧化还原反应计算、氧化还原反应概念等,难度中等,熟练掌握氧化还原反应中电子转移守恒思想的运用.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
16.2015年10月5日,中国女药学家屠呦呦与另外两位科学家共享2015年诺贝尔生理学或医学奖.屠呦呦因发现冶疗疟疾新型药物青蒿素和双氢青蒿素而获奖.青蒿素的分子式为C15H22O5.下列有关说法中正确的是( )

| A. | 青蒿素中氧元素的质量为80g | B. | 双氢青蒿素能发生酯化反应 | ||
| C. | 双氢青蒿素能与溴水发生加成反应 | D. | 青蒿素和双氢青蒿素均含羟基 |
17.下列说法正确的是( )
| A. | 得电子越多,其氧化性越强 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 要完成SO32-→SO42-的转化,必须加入氧化剂 | |
| D. | 金属活动顺序表中,排在前面的金属阳离子的氧化性强于排在后面的金属阳离子 |
1.室温下,甲乙两烧杯中分别盛有pH=a和pH=(a+1)的醋酸溶液,下列说法正确的是( )
| A. | 若甲烧杯中溶液浓度为0.1 mol•L-1,则乙烧杯中溶液浓度大于0.01 mol•L-1 | |
| B. | 向甲烧杯中加入等体积pH=(14-a)的NaOH溶液后,溶液显碱性 | |
| C. | 两溶液中水电离出的OH-浓度:10C甲(OH-)<C乙(OH-) | |
| D. | 取等体积甲乙溶液分别与适量NaOH溶液完全中和,所得溶液的pH:甲>乙 |
11.下列装置或操作正确,且能达到目的是( )
| A. | 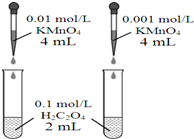 依据褪色快慢比较浓度对反应速率的影响 | |
| B. | 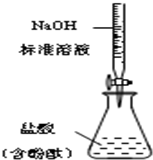 测定盐酸浓度 | |
| C. | 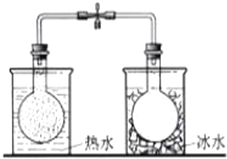 依据气体颜色变化,证明温度对平衡移动的影响 | |
| D. | 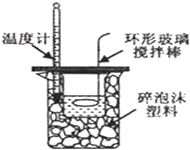 中和热的测定 |
18.下列叙述正确的是( )
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 | |
| C. | 氯气具有漂白性 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
15.下列说法中正确的是( )
| A. | 原子最外层电子数大于4的元素不一定是非金属元素 | |
| B. | 同周期的主族元素从左到右,非金属性逐渐增强,气态氢化物稳定性逐渐减弱 | |
| C. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素不一定是金属元素 | |
| D. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 |
16.Li原子核外有3个电子,则Li元素最多有几个不同电离能( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 无法判断 |