题目内容
3.在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况,下列反应中属于这种情况的是( )①过量的锌与浓硫酸反应;②过量的氢气与少量的N2在工业生产条件下反应;③过量的浓盐酸与碳酸钙反应;④过量二氧化锰与浓盐酸在加热条件下反应;⑤过量的铜与浓硫酸在加热条件下反应.
| A. | ②③④ | B. | ②④⑤ | C. | ①②④ | D. | ③④⑤ |
分析 从两个角度考虑,一是可逆反应,可逆反应不能进行到底;二是物质的性质与浓度有关,例如某些酸在浓度较大时具有较强的氧化性或还原性,当浓溶液时可以发生反应,但随着反应的消耗,变成稀溶液往往就不具备继续反应的性质,据此解答.
解答 解:①锌与浓硫酸、稀硫酸都反应,锌过量,硫酸最后完全反应,故不选;
②氨气与氢气合成氨属于可逆反应,可逆反应不能进行到底,所以一种物质过量,另一种物质仍不能完全反应,故选;
③过量的浓盐酸与碳酸钙反应,碳酸钙能够完全反应,故不选;
④二氧化锰与浓盐酸在加热条件下反应,与稀盐酸不反应,随着反应进行盐酸浓度降低,不再反应,所以过量二氧化锰与浓盐酸反应,盐酸剩余,故选;
⑤铜与浓硫酸在加热条件下反应,铜与稀硫酸不反应,所以铜过量,硫酸最后仍有剩余,故选;
故选:B.
点评 本题考查物质的性质,题目难度不大,注意化学反应中的一些特殊情况,注意反应的可逆性和物质的浓度问题.

练习册系列答案
相关题目
13.下列物质的用途中,不正确的是( )
| A. | 硅酸钠:木材防火剂 | B. | 二氧化硅:太阳能电池板 | ||
| C. | 过氧化钠:供氧剂 | D. | 小苏打:发酵粉主要成份 |
11.下列装置或操作正确,且能达到目的是( )
| A. |  依据褪色快慢比较浓度对反应速率的影响 | |
| B. |  测定盐酸浓度 | |
| C. |  依据气体颜色变化,证明温度对平衡移动的影响 | |
| D. | 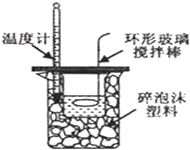 中和热的测定 |
18.下列叙述正确的是( )
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 | |
| C. | 氯气具有漂白性 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
15.下列说法中正确的是( )
| A. | 原子最外层电子数大于4的元素不一定是非金属元素 | |
| B. | 同周期的主族元素从左到右,非金属性逐渐增强,气态氢化物稳定性逐渐减弱 | |
| C. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素不一定是金属元素 | |
| D. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 |