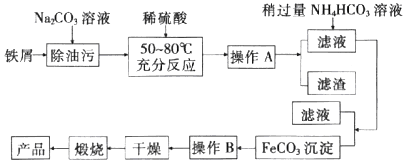
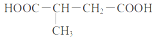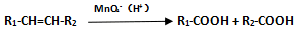题目内容
17.一定质量的甲烷燃烧后的产物为CO、CO2和水蒸气,此混合气体质量为99.2g,当其缓慢经过无水CaCl2时,CaCl2增重50.4g.原混合气体中CO2的质量为( )| A. | 13.2 g | B. | 22.4g | C. | 24.4g | D. | 26.4g |
分析 CH4燃烧产物为CO、CO2、H2O(g),产物通过无水CaCl2时,无水CaCl2的作用是吸收水分,无水CaCl2增重25.2g为水的质量,根据H原子守恒可计算CH4的物质的量,根据C原子守恒可计算CO和CO2的总的物质的量,再根据二者质量可计算CO2的物质的量,进而计算CO2质量.
解答 解:无水CaCl2增重25.2g为水的质量,所以n(H2O)=$\frac{50.4g}{18g/mol}$=2.8mol,
根据H原子守恒,可知:n(CH4)=$\frac{1}{2}$n(H2O)=$\frac{1}{2}$×2.8mol=1.4mol,
根据C原子守恒,则:n(CO)+n(CO2)=1.4mol,
所以m(CO)+m(CO2)=99.2g-50.4g=48.8g,
所以[1.4mol-n(CO2)]×28g/mol+n(CO2)×44g/mol=48.8g,
解之:n(CO2)=0.6mol,
所以生成二氧化碳的质量为0.6mol×44g/mol=26.4g.
故选:D.
点评 本题考查混合物的计算,难度中等,注意从原子守恒的角度解答,关键根据水的质量判断甲烷的物质的量.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
7.设NA表示阿佛加德罗常数值,下列说法正确的是( )
| A. | 500mL0.1mol•L-1的Al2(SO4)3溶液中,含Al3+0.1NA | |
| B. | 36g重氧(18O2)气体所含分子数为NA,占体积为22.4L | |
| C. | 7.8gNa2O2与足量CO2反应,转移电子数为0.1NA | |
| D. | 15g甲基中含有的电子数为8NA |
5.对下列实验事实的解释不正确的是( )
| 现 象 | 解释或结论 | |
| A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
| B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成有色物质且能溶于浓硝酸 |
| C | 向饱和Na2CO3中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| A. | A | B. | B | C. | C | D. | D |
2.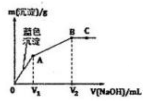 向含MgCl2和CuCl2的溶液中逐滴加入0.1 mol•L-1的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1,下列说法正确的是( )
向含MgCl2和CuCl2的溶液中逐滴加入0.1 mol•L-1的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1,下列说法正确的是( )
 向含MgCl2和CuCl2的溶液中逐滴加入0.1 mol•L-1的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1,下列说法正确的是( )
向含MgCl2和CuCl2的溶液中逐滴加入0.1 mol•L-1的NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1,下列说法正确的是( )| A. | 水的电离程度:A>B>C | |
| B. | 该实验不能证明Cu(OH)2的Ksp比Mg(OH)2的Ksp小 | |
| C. | 原溶液中MgCl2和CuCl2的物质的量浓度相等 | |
| D. | 若向Mg(OH)2悬浊液中加入CuCl2溶液,一定会有Cu(OH)2生成 |
9.当可逆反应CO+H2(g)?CO2+H2达到平衡后,改变条件达到新的平衡,体系中二氧化碳的体积百分含量增大,则平衡( )
| A. | 一定向正反应方向移动 | |
| B. | 一定向逆反应方向移动 | |
| C. | 不移动 | |
| D. | 可能向正反应方向移动,也可能向逆反应方向移动 |
13.对于反应N2+O2$\frac{\underline{\;一定条件\;}}{\;}$2NO在密闭容器中进行,下列哪些条件能加快反应的速率( )
| A. | 缩小体积使压强增大 | B. | 增大体积使压强减小 | ||
| C. | 体积不变充入H2使压强增大 | D. | 压强不变充入N2使体积增大 |
14.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平,青铜(约6000年前)、Fe(约2500年前)、Al(约200年前)之所以有先有后,主要取决于( )
| A. | 金属的导电性强弱 | B. | 金属在地壳中的含量多少 | ||
| C. | 金属的化合价高低 | D. | 金属的活动性强弱 |