题目内容
5.对下列实验事实的解释不正确的是( )| 现 象 | 解释或结论 | |
| A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
| B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成有色物质且能溶于浓硝酸 |
| C | 向饱和Na2CO3中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.酸性高锰酸钾溶液与二氧化硫发生氧化还原反应,二氧化硫表现了还原性;
B.浓硝酸不稳定,易分解;
C.碳酸钠的溶解度大于碳酸氢钠;
D.溶液变蓝,说明反应生成碘单质,从而证明铁离子能够将碘离子氧化成碘单质.
解答 解:A.SO2使酸性高锰酸钾溶液褪色,发生氧化还原反应,生成硫酸根离子,S元素的化合价升高,则体现二氧化硫的还原性,故A错误;
B.浓硝酸不稳定,易分解,生成的二氧化氮能溶于浓硝酸则变黄,故B正确;
C.向饱和Na2CO3溶液中通入足量CO2,反应生成了溶解度较小的碳酸氢钠,从而有碳酸氢钠析出,溶液变浑浊,故C正确;
D.室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色,说明有碘单质生成,可以证明Fe3+的氧化性比I2的强,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及氧化还原反应、二氧化硫、浓硝酸性质等知识,把握物质的性质及反应现象的分析为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
15.已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )
| A. | 32 | B. | 32 g | C. | 64 g/mol | D. | 32 g/mol |
13.下列离子方程式书写不正确的是( )
| A. | NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时:4OH-+3SO2=SO32-+2HSO3-+H2O | |
| B. | 向含1mol的NaOH溶液中通入1mol的H2S气体:H2S+2OH-=S2-+2H2O | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 1mol/L的NaAlO2溶液和2.5mol/L的HCl等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
10.下列说法正确的是( )
| A. | 某反应正、逆反应的活化能分别为EakJ/mol、EbkJ/mol,则△H=-(Ea-Eb)kJ/mol | |
| B. | H2的热值为142.9kJ/g,则有2H2(g)+O2(g)═2H2O (1)△H=-285.8kJ/mol | |
| C. | 将浓度为0.1mol/LHF溶液加水不断稀释过程中,$\frac{c({F}^{-})}{c({H}^{+})}$始终保持减小 | |
| D. | 混合前$\frac{c(C{H}_{3}COOH)}{c(NaOH)}$=2,等体积的混合后溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$=$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$ |
17.一定质量的甲烷燃烧后的产物为CO、CO2和水蒸气,此混合气体质量为99.2g,当其缓慢经过无水CaCl2时,CaCl2增重50.4g.原混合气体中CO2的质量为( )
| A. | 13.2 g | B. | 22.4g | C. | 24.4g | D. | 26.4g |
1.有时候,将氧化还原反应方程式拆开写成两个“半反应”.下面是一个“半反应”式:MnO4-+____H++____e---____Mn2++____H2O
该反应方程式的配平化学计量数是( )
该反应方程式的配平化学计量数是( )
| A. | 1,8,4,1,4 | B. | 2,16,5,2,8 | C. | 1,6,5,1,3 | D. | 1,8,5,1,4 |
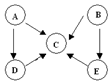 A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.其中A、B、C、D在常温下都是气体,B为红棕色.
A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.其中A、B、C、D在常温下都是气体,B为红棕色.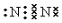 ,D的结构式:
,D的结构式: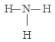 .
.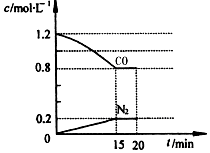 2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.
2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.


