题目内容
11.25℃时,若pH=a的10体积某强酸溶液与pH=b的1体积某强碱溶液混合后溶液呈中性,则混合之前该强酸的pH与强碱的pH之间应满足的关系( )| A. | a+b=14 | B. | a+b=13 | C. | a+b=15 | D. | a+b=7 |
分析 常温下,PH=a的强酸溶液中氢离子浓度为10-a mol/L,PH=b的强碱溶液中氢氧根离子浓度为10 b-14 mol/L,混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量.
解答 解:常温下,PH=a的强酸溶液中氢离子浓度为10-a mol/L,PH=b的强碱溶液中氢氧根离子浓度为10 b-14 mol/L,混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,所以10×10-a=1×10 b-14,10a+b=1015,所以a+b=15,
故选C.
点评 本题考查了酸碱混合溶液定性判断,明确溶液的pH与氢离子、氢氧根离子浓度的关系是解本题关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.用盐酸标准液滴定氨水,至中性时,关于酸碱是否完全中和,下列说法正确的是( )
| A. | n(HCl)<n(NH3•H2O) | B. | 盐酸过量 | C. | 恰好中和 | D. | 无法判断 |
8.现有常温下pH=2的醋酸溶液,下列有关叙述正确的是( )
| A. | c(H+)=c(CH3COO-) | |
| B. | 醋酸的物质的量浓度为0.01mol•L-1 | |
| C. | 与pH=12的NaOH溶液等体积混合后,溶液呈碱性 | |
| D. | 加入醋酸钠固体可抑制醋酸的电离,但电离常数Ka不变 |
5.在H2S水溶液中,加入一些Na2S固体,将使( )
| A. | H2S解离度增大 | B. | H2S平衡常数减小 | C. | 溶液pH下降 | D. | 溶液pH增大 |
6. 小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
 小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )
小明同学在总结酸、碱、盐之间的相互反应关系时发现,选用适当物质既可实现如图中所示的所有反应.若中间的物质为硫酸钡,那么对酸、碱、甲盐、乙盐四种物质的推断中,合理的是( )| A. | HCl NaOH BaCl2Na2SO4 | B. | H2SO4 Ba(OH)2K2SO4Ba(NO3)2 | ||
| C. | H2SO4Ba(OH)2Na2SO4BaCl2 | D. | H2SO4NaOH BaCl2Na2SO4 |
16.下列关于燃烧热的说法正确的是( )
| A. | 1mol纯物质完全燃烧时所放出的热量,叫该物质的燃烧热 | |
| B. | 放热反应热化学方程式中△H就是该反应物的燃烧热 | |
| C. | 物质的燃烧热可利用仪器由实验测得 | |
| D. | 物质燃烧必然伴随发光发热现象且肯定是氧化还原反应 |
3.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
20.下列有机化学反应方程式书写及反应类型均正确的是( )
| A. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl 加聚反应 | |
| B. | CH3COOH+CH3CH2OH $?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O 酯化反应 | |
| C. | 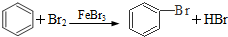 加成反应 加成反应 | |
| D. | 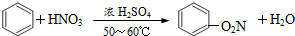 取代反应 取代反应 |
1.下列对聚丙烯酸酯不正确的说法是( )
| A. | 单体的结构简式为CH2═CHCOOR | B. | 在一定条件下能发生加成反应 | ||
| C. | 在一定条件下能发生水解反应 | D. | 没有固定熔沸点 |