题目内容
已知在常温下可以发生下列反应:H2SO3+I2+H2O=4H++2I-+SO42-2Fe3++2I-=2Fe2++I23Fe2++4H++NO-=3Fe3++NO+2H2O则有关物质的还原性由强到弱的顺序是( )
| A、H2SO3>I->Fe2+>NO |
| B、I->Fe2+>H2SO3>NO |
| C、Fe2+>I->H2SO3>NO |
| D、NO>Fe2+>I->H2SO3 |
考点:氧化性、还原性强弱的比较
专题:氧化还原反应专题
分析:在氧化还原反应中,失电子化合价升高的反应物是还原剂,得电子的物质为氧化剂,氧化剂反应后的产物为还原产物,氧化还原反应中还原剂的还原性大于还原产物的还原性,据此分析解答.
解答:
解:H2SO3+I2+H2O=4H++2I-+SO42-中还原性:H2SO3>I-;
2Fe3++2I-=2Fe2++I2中还原性:I->Fe2+;
3Fe2++4H++NO-=3Fe3++NO+2H2O中还原性:Fe2+>NO;
则还原性:H2SO3>I->Fe2+>NO;
故选A.
2Fe3++2I-=2Fe2++I2中还原性:I->Fe2+;
3Fe2++4H++NO-=3Fe3++NO+2H2O中还原性:Fe2+>NO;
则还原性:H2SO3>I->Fe2+>NO;
故选A.
点评:本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及氧化性、还原性比较和应用的考查,注重分析能力及知识应用能力的训练,题目难度不大.

练习册系列答案
相关题目
对热化学方程式C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ?mol-1最准确的理解是( )
| A、碳和水反应吸收131.3 kJ热量 |
| B、1 mol碳和1 mol水反应生成一氧化碳和氢气,同时放出131.3 kJ热量 |
| C、1 mol碳和1 mol水蒸气反应生成1 mol CO和1 mol H2,同时吸收131.3 kJ热量 |
| D、1个固态碳原子和1分子水蒸气反应吸热131.1 kJ |
下列实验中所选用的仪器合理的是( )
| A、用200mL量筒量取5.2mL稀硫酸 |
| B、用碱式滴定管量取22.10mL溴水 |
| C、用托盘天平称取11.70g食盐 |
| D、用250mL容量瓶配制230mL0.2 mol?L-1的氢氧化钠溶液 |
下列说法正确的是( )
| A、汽油、柴油和植物油都是碳氢化合物 |
B、β-月桂烯的结构如图 ,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 ,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 |
| C、植物油通过加氢可以变为脂肪 |
| D、煤中含有苯、甲苯、二甲苯等芳香烃,可通过干馏制取 |
某溶液中含有大量的下列离子:Mg2+、NO3-、K+和M离子,经测定Mg2+、NO3-、K+离子的物质的量之比为2:4:1,则M离子可能是下列中的( )
| A、Cl- |
| B、SO42- |
| C、OH- |
| D、Na+ |
下列各组物质属于同分异构体的是( )
A、 和 和 |
| B、O2和O3 |
| C、CH3CH2OH和CH3OCH3 |
| D、12C和13C |
下列反应属于放热反应的是( )
| A、镁条在氧气中燃烧 |
| B、煅烧石灰石 |
| C、Ba(OH)2?8H2O晶体与NH4Cl晶体反应 |
| D、灼热的碳与CO2的反应 |
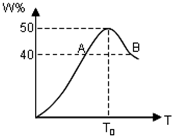 2L容器中,分别将物质的量均为2.00mol的X、Y混合,在不同温度(T)下发生如下反应:2X(g)+Y(g)?2W(g).并在第10s时分别测定其中W的体积分数(W%),并绘成如图所示曲线:
2L容器中,分别将物质的量均为2.00mol的X、Y混合,在不同温度(T)下发生如下反应:2X(g)+Y(g)?2W(g).并在第10s时分别测定其中W的体积分数(W%),并绘成如图所示曲线: