题目内容
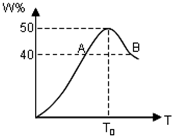 2L容器中,分别将物质的量均为2.00mol的X、Y混合,在不同温度(T)下发生如下反应:2X(g)+Y(g)?2W(g).并在第10s时分别测定其中W的体积分数(W%),并绘成如图所示曲线:
2L容器中,分别将物质的量均为2.00mol的X、Y混合,在不同温度(T)下发生如下反应:2X(g)+Y(g)?2W(g).并在第10s时分别测定其中W的体积分数(W%),并绘成如图所示曲线:(1)此反应的正反应为
(2)A点对应的υ正和υ逆的关系:υ正
. |
| v |
(3)温度T<T0时,W%逐渐增大的原因是
(4)若B点W的体积分数为40.0%,则参加反应的X的转化率为
(5)在规定时间内,若要提高W的产量,可以采取的措施有:
考点:化学平衡的影响因素,反应热和焓变
专题:化学平衡专题
分析:(1)随着温度的继续升高(T0时达平衡状态),W的物质的量分数逐渐减小,说明温度升高平衡左移;
(2)随着温度的升高,反应向正反应方向进行,当温度达到T0时,W的物质的量分数最大,说明达到反应的最大限度,即平衡状态,则在A点未到达平衡,还继续向正方向进行;根据温度越高,化学反应速率越快;先根据三段式计算参加反应的Y的量,再求出反应速率;
(3)随着温度的升高,反应向正反应方向进行,当温度达到T0时,W的物质的量分数最大,说明达到反应的最大限度,即平衡状态;
(4)先根据三段式计算参加反应的X的量,再求出转化率;
(5)根据平衡移动原理分析;
(2)随着温度的升高,反应向正反应方向进行,当温度达到T0时,W的物质的量分数最大,说明达到反应的最大限度,即平衡状态,则在A点未到达平衡,还继续向正方向进行;根据温度越高,化学反应速率越快;先根据三段式计算参加反应的Y的量,再求出反应速率;
(3)随着温度的升高,反应向正反应方向进行,当温度达到T0时,W的物质的量分数最大,说明达到反应的最大限度,即平衡状态;
(4)先根据三段式计算参加反应的X的量,再求出转化率;
(5)根据平衡移动原理分析;
解答:
解:(1)由图象得随着温度的继续升高(T0时达平衡状态),W的物质的量分数逐渐减小,说明温度升高平衡左移,则正反应为放热反应,
故答案为:放;
(2)随着温度的升高,反应向正反应方向进行,当温度达到T0时,W的物质的量分数最大,说明达到反应的最大限度,即平衡状态,则在A点未到达平衡,还继续向正方向进行,所以A点中v正>v逆,
根据温度越高,化学反应速率越,所以A、B两点正反应速率关系vA<vB
设参加反应的氧气为xmol
2X(g)+Y(g)?2W(g)
起始的量:2mol 2mol 0
转化的量:2x x 2x
平衡的量:2-2x 2-x 2x
W的物质的量分数为50%,所以
×100%=50%,所以x=0.8mol,则v(Y)=
=
=0.04 mol/(L?s),
故答案为:>;<;0.04 mol/(L?s);
(3)随着温度的升高,反应向正反应方向进行,当温度达到T0时,W的物质的量分数最大,说明达到反应的最大限度,即平衡状态,温度T<T0时,反应一直向正反应方向进行;
故答案为:反应未到底平衡,一直向正反应方向进行;
(4)设参加反应的Y为xmol
2X(g)+Y(g)?2W(g)
起始的量:2mol 2mol 0
转化的量:2x x 2x
平衡的量:2-2x 2-x 2x
W的物质的量分数为40%,所以所以
×100%=40%,所以x=
mol,所以n(X)=2x=
mol,所以X的转化率为
×100%=66.7%,故答案为:66.7%;
(5)若要提高W的产量,即平衡向正反应方向移动,根据平衡移动原理可以采取的措施有:降低温度,升高压强,或者增加反应物的量或者移走W;
故答案:降低温度,升高压强,或者增加反应物的量或者移走W.
故答案为:放;
(2)随着温度的升高,反应向正反应方向进行,当温度达到T0时,W的物质的量分数最大,说明达到反应的最大限度,即平衡状态,则在A点未到达平衡,还继续向正方向进行,所以A点中v正>v逆,
根据温度越高,化学反应速率越,所以A、B两点正反应速率关系vA<vB
设参加反应的氧气为xmol
2X(g)+Y(g)?2W(g)
起始的量:2mol 2mol 0
转化的量:2x x 2x
平衡的量:2-2x 2-x 2x
W的物质的量分数为50%,所以
| 2x |
| 2-2x+(2-x)+2x |
| △C |
| △t |
| 0.8mol/2L |
| 10s |
故答案为:>;<;0.04 mol/(L?s);
(3)随着温度的升高,反应向正反应方向进行,当温度达到T0时,W的物质的量分数最大,说明达到反应的最大限度,即平衡状态,温度T<T0时,反应一直向正反应方向进行;
故答案为:反应未到底平衡,一直向正反应方向进行;
(4)设参加反应的Y为xmol
2X(g)+Y(g)?2W(g)
起始的量:2mol 2mol 0
转化的量:2x x 2x
平衡的量:2-2x 2-x 2x
W的物质的量分数为40%,所以所以
| 2x |
| 2-2x+(2-x)+2x |
| 2 |
| 3 |
| 4 |
| 3 |
| ||
| 2 |
(5)若要提高W的产量,即平衡向正反应方向移动,根据平衡移动原理可以采取的措施有:降低温度,升高压强,或者增加反应物的量或者移走W;
故答案:降低温度,升高压强,或者增加反应物的量或者移走W.
点评:本题考查了反应速率的计算,转化率的计算,外界条件对化学反应速率、化学平衡的影响,难度一般,根据有关公式即可求算.

练习册系列答案
相关题目
下列实验设计方案中,可行的是( )
| A、用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 |
| B、在某试样中加入NaOH溶液加热,产生能使蓝色石蕊试纸变红的气体即证明有NH4+ |
| C、焰色反应实验中用硫酸清洗铁丝,灼烧后再沾取试样在酒精灯上灼烧观察 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
W克下列物质电火花引燃后的产物通过足量的Na2O2后,固体增重大于W克的是( )
| A、CO与H2的混合气体 |
| B、CH3CH2OH |
| C、HCOOH |
| D、CH3COOH |
某无色气体,可能含HCl、CO2、NO2、HI、SO2、HBr的一种或几种.将其通人氯水中,得到无色透明溶液,把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出 现白色沉淀,另一份加入硝酸酸化的AgNO3溶液,也有白色沉淀生成.对于原无色气体推断一定正确的是( )
| A、一定存在HCl |
| B、一定存在SO2 |
| C、肯定没有CO2 |
| D、不能肯定是否含有NO2、HI |
已知在常温下可以发生下列反应:H2SO3+I2+H2O=4H++2I-+SO42-2Fe3++2I-=2Fe2++I23Fe2++4H++NO-=3Fe3++NO+2H2O则有关物质的还原性由强到弱的顺序是( )
| A、H2SO3>I->Fe2+>NO |
| B、I->Fe2+>H2SO3>NO |
| C、Fe2+>I->H2SO3>NO |
| D、NO>Fe2+>I->H2SO3 |
下列措施不合理的是( )
| A、用SO2漂白纸浆和草帽辫 |
| B、用硫酸清洗锅炉中的水垢 |
| C、高温下用焦炭还原SiO2制取粗硅 |
| D、用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+ |
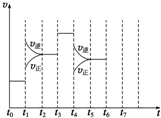 在一密闭容器中发生反应N2+3H2?2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2?2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示: