题目内容
3.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,实验室以孔雀石为原料制备CuSO4•5H2O及CaCO3,步骤如下: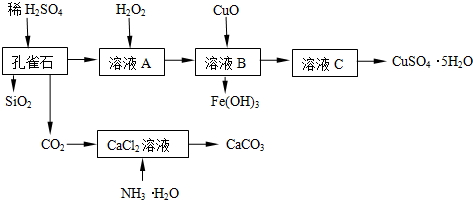
试回答下列问题:
(1)在未加入H2O2的溶液A中,存在的金属离子有Cu2+、Fe2+、Fe3+.若检验该溶液中Fe3+,你所选择的最合适的试剂是D(填代号).
A.KMnO4 B.Fe粉 C.Na2CO3 D.KSCN
向溶液A中加入H2O2,H2O2在该反应中作氧化剂.实验室选用H2O2而不用Cl2作氧化剂除考虑环保因素外的另一原因是没有引入其它杂质离子.
(2)实验过程中需要进行多次过滤操作,除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器,该仪器在此操作中的主要作用是引流.
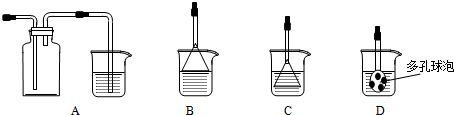
(3)制备CaCO3时,发生反应的化学方程式是CO2+CaCl2+2NH3•H2O=CaCO3↓+2NH4Cl+H2O;若实验过程中有氨气逸出、应选用下列装置B(填代号)回收.
分析 由制备实验流程可知,Cu2(OH)2CO3、少量Fe的氧化物均与硫酸反应,只有SiO2不反应,溶液A中含Cu2+、Fe2+、Fe3+,加H2O2的溶液将亚铁离子氧化为铁离子,则溶液B中含Cu2+、Fe3+,加CuO促进铁离子水解转化为沉淀,所以溶液C中主要为硫酸铜,蒸发浓缩、冷却结晶得到CuSO4•5H2O;
制备CaCO3时,先通入氨气,增大二氧化碳的溶解,生成碳酸铵与氯化钙反应生成碳酸钙、氯化铵,则过滤可得到CaCO3,以此来解答.
解答 解:(1)若检验该溶液中Fe3+,可加入KSCN,溶液变为红色,向溶液A加入H2O2将亚铁离子氧化为铁离子,选用H2O2而不用Cl2的原因是不引入新杂质Cl-,
故答案为:D; 没有引入其它杂质离子;
(2)由溶液C获得CuSO4•5H2O,需要经过蒸发浓缩、冷却结晶、过滤等操作.除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器是玻璃棒,起引流作用,
故答案为:引流;
(3)使CaCl2溶液中生成CaCO3,须在溶液显碱性的条件下通CO2,为使溶液显碱性,可向溶液中先通NH3,发生CO2+CaCl2+2NH3•H2O=CaCO3↓+2NH4Cl+H2O,
NH3极易溶于水,吸收多余NH3时要防止倒吸,图中B的倒扣漏斗,A中气体收集时导管应短进,C、D中气体直接与水接触而不能防止倒吸,
故答案为:CO2+CaCl2+2NH3•H2O=CaCO3↓+2NH4Cl+H2O;B.
点评 本题考查物质制备实验方案的设计,为高频考点,把握制备实验流程中的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意除杂不能引入新杂质及防倒吸装置的选择,题目难度中等.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
9.实验室里需要480mL 0.100mol/L的CuSO4溶液,以下操作正确的是( )
| A. | 称取7.68gCuSO4,加入500mL水 | |
| B. | 称取12.5g胆矾,配成480mL溶液 | |
| C. | 称取8.0gCuSO4,加入到500mL水中配成溶液 | |
| D. | 称取12.5g胆矾,配成500mL溶液 |
10.2015年 10月,中国科学家屠呦呦获得了诺贝尔生理学奖,获奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.青蒿素的分子式为 C15H22O5,则关于青蒿素的说法中正确的是( )
| A. | 青蒿素是一种氧化物 | |
| B. | 青蒿素的摩尔质量为 282 | |
| C. | 56.4g青蒿素中所含氧原子数目为 6.02×1023个 | |
| D. | 青蒿素中 C、H、O元素的质量比为 15:22:5 |
7.反应物X转化为Y和Z的能量变化如图所示.下列说法正确的是( )
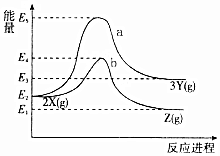

| A. | X→Y反应的活化能为E5 | |
| B. | 加入催化剂曲线a变为曲线b | |
| C. | 升高温度增大吸热反应的活化能,从而使化学反应速率加快 | |
| D. | 压缩容器体积不改变活化能,但增大单位体积活化分子数,使得反应速率加快 |
14.据《俄新网》报道,萨彦斯克化工塑料厂一个生产二氯乙烷的高炉发生爆炸事故.该化工厂是俄罗斯一家最大的聚氯乙烯树脂生产厂家.下列有关二氯乙烷的说法不正确的是 ( )
| A. | 二氯乙烷与四氯乙烷的同分异构体数相同 | |
| B. | 在光照条件下,乙烷与氯气反应不能制备纯净的二氯乙烷 | |
| C. | 二氯乙烷和硝酸银溶液反应产生白色沉淀 | |
| D. | 二氯乙烷发生消去反应可以得到乙炔 |
8.氨和铵盐既是实验室常用试剂又是重要化工原料.
(1)氨水的电离方程式为NH3•H2O?NH4++OH-.硫酸铵在水溶液中水解的离子方程式为NH4++H2O?NH3•H2O+H+.
(2)常温下,用0.1000mol•L-1盐酸滴定0.1000mol•L-1氨水,其滴定曲线如图所示.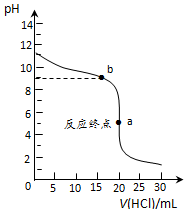
①该滴定适宜的指示剂为甲基橙(选填:“甲基橙”、“酚酞”、“石蕊”).
②图中“a”点处溶液中四种离子浓度从大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
③已知图中“b”点处,溶液中满足4c(NH4+)=7c(NH3•H2O),则常温时Kb(NH3•H2O)=1.75×10-5(填数值).
(3)实验室常利用甲醛法测定硫酸铵样品中氮元素的质量分数,反应原理为:
4NH4++6HCHO═4H++(CH2)6N4+6H2O; H++OH-═H2O
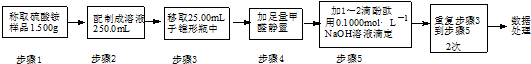
滴定结果如表所示:
试计算该样品中氮元素的质量分数(写出计算过程)计算平均消耗溶液体积V=$\frac{20.01ml+19.99ml+20.00ml}{3}$=20.00ml,
结合元素守恒,n(N)=n(NH4+)=n(NaOH)=0.1000mol•L-1×20.00mL×10-3L•mL-1=2.000×10-3mol,w(N)=$\frac{14g/mol×2.000×1{0}^{-3}mol}{1.500g×\frac{25.00mL}{250.0mL}}$≈18.67%,.
(1)氨水的电离方程式为NH3•H2O?NH4++OH-.硫酸铵在水溶液中水解的离子方程式为NH4++H2O?NH3•H2O+H+.
(2)常温下,用0.1000mol•L-1盐酸滴定0.1000mol•L-1氨水,其滴定曲线如图所示.

①该滴定适宜的指示剂为甲基橙(选填:“甲基橙”、“酚酞”、“石蕊”).
②图中“a”点处溶液中四种离子浓度从大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
③已知图中“b”点处,溶液中满足4c(NH4+)=7c(NH3•H2O),则常温时Kb(NH3•H2O)=1.75×10-5(填数值).
(3)实验室常利用甲醛法测定硫酸铵样品中氮元素的质量分数,反应原理为:
4NH4++6HCHO═4H++(CH2)6N4+6H2O; H++OH-═H2O

滴定结果如表所示:
| 滴定次数 | 待测溶液的 体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.01 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.30 | 20.30 |
结合元素守恒,n(N)=n(NH4+)=n(NaOH)=0.1000mol•L-1×20.00mL×10-3L•mL-1=2.000×10-3mol,w(N)=$\frac{14g/mol×2.000×1{0}^{-3}mol}{1.500g×\frac{25.00mL}{250.0mL}}$≈18.67%,.
12.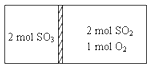 一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g)H=196kJ•moL现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的( )
一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g)H=196kJ•moL现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的( )
 一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g)H=196kJ•moL现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的( )
一定条件下存在反应:2SO2(g)+O2(g)?2SO3(g)H=196kJ•moL现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的( )| A. | 恒温条件下,达到平衡容器两边SO3的体积分数相同 | |
| B. | 恒温条件下,容器中两边的吸收或放出的热量数值之和小于为196kJ | |
| C. | 若容器为绝热,达到平衡时右室反应速率等于左室反应速率 | |
| D. | 若容器为绝热容器,右室中SO2的转化率与左室SO3的转化率之和小于1 |
13.铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2$\frac{\underline{\;高温\;}}{\;}$2PbO+2SO2;③制粗铅:PbO+C$\frac{\underline{\;高温\;}}{\;}$Pb+CO;PbO+CO$\frac{\underline{\;高温\;}}{\;}$Pb+CO2.下列说法正确的是( )
| A. | 将1 mol PbS冶炼成Pb理论上至少需要6 g碳 | |
| B. | 浮选法富集方铅矿的过程属于化学变化 | |
| C. | 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO | |
| D. | 整个冶炼过程中,制取1 mol Pb共转移2 mol电子 |