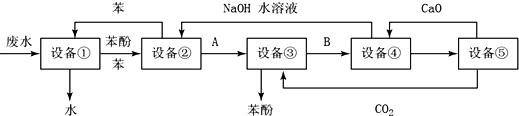
题目内容
12.碘酸钙[Ca(IO3)2]既能补碘又能补钙的新型食品和饲料添加剂.碘酸钙可通过下列途径合成.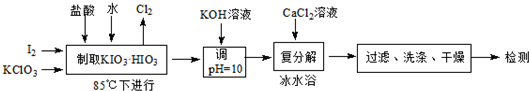
(1)若称取的I2质量为3.810g,为使I2充分氧化,则投料时KClO3的质量至少为3.675;同时生成的氯气体积为336mL(标准状况).
(2)用KOH溶液调节pH的目的是将KIO3•HIO3转变为KIO3.
(3)已知几种盐的溶解度(g/100g水)如下:
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| KCl | 28.1 | 31.2 | 34.2 | 40.1 | 45.8 | 51.3 |
| Ca(IO3)2 | 0.119 | 0.195 | 0.3071 | 0.520 | 0.621 | 0.669 |
| 碘酸钙存在形态 | 无水盐 | 一水合物 | 六水合物 |
| 稳定时的温度区域 | >57.5℃ | 32-57.5℃ | <32℃ |
(4)准确称取产品0.6000g于烧标中,加1:1高氯酸20mL,微热溶解后,冷却,配成250.00mL溶液.移取上述溶液50.00mL置于250mL碘量瓶中,加入1:1高氯酸2mL、3gKI(足量)(发生:IO3-+5I-+6H+═3I2+3H2O),盖上瓶盖,暗处放置3min,加50mL水,加入0.3%淀粉溶液2mL,用0.1000mol•L-1Na2S2O3溶液滴定(发生:I2+2S2O32-═2I-+S4O62-)到终点时消耗12.00mL,试计算产品中Ca(IO3)2的质量分数(给出计算过程).
分析 根据流程图知,碘、氯酸钾、盐酸在85℃条件下反应生成KClO3.HClO3、KCl和氯气,I2+2KClO3+HCl$\frac{\underline{\;\;△\;\;}}{\;}$KIO3.HIO3+KCl+Cl2↑,向溶液中KOH溶液并调节溶液的pH=10,溶液中发生的反应为KOH+HIO3=KIO3+H2O,向溶液中加入氯化钙溶液,发生复分解反应生成[Ca(IO3)2]沉淀,然后过滤、洗涤、干燥得到[Ca(IO3)2]固体;
(1)根据方程式中碘与氯酸钾、氯气的关系式计算消耗的氯酸钾质量及生成氯气体积;
(2)溶液中含有碘酸,碘酸能和KOH溶液反应生成碘酸钾;
(3)根据表中数据知,温度越低,碘酸钙的溶解度越小;在<32℃得到碘酸钙的六水合物;
(4)根据Ca(IO3)2、IO3-+5I-+6H+═3I2+3H2O、I2+2S2O32-═2I-+S4O62-得关系式
IO3-----6S2O32-,
n(Na2S2O3)=0.1000 mol•L-1×12.00mL×10-3L•mL-1=1.200×10-3mol
n(IO3-)=$\frac{1}{3}$n(I2)=$\frac{1}{6}$ n(Na2S2O3)=2.000×10-4mol
m[Ca(IO3)2]=1.000×10-4mol×390g•mol-1=0.039g
样品中m[Ca(IO3)2]=$\frac{250mL}{50mL}$×0.039g=0.195g,
其质量分数=$\frac{碘酸钙质量}{样品质量}×100%$.
解答 解:根据流程图知,碘、氯酸钾、盐酸在85℃条件下反应生成KClO3.HClO3、KCl和氯气,I2+2KClO3+HCl$\frac{\underline{\;\;△\;\;}}{\;}$KIO3.HIO3+KCl+Cl2↑,向溶液中KOH溶液并调节溶液的pH=10,溶液中发生的反应为KOH+HIO3=KIO3+H2O,向溶液中加入氯化钙溶液,发生复分解反应生成[Ca(IO3)2]沉淀,然后过滤、洗涤、干燥得到[Ca(IO3)2]固体;
(1)n(I2)=$\frac{3.810g}{254g/mol}$=0.015mol,根据I2+2KClO3+HCl$\frac{\underline{\;\;△\;\;}}{\;}$KIO3.HIO3+KCl+Cl2↑知,n(KClO3)=2n(I2)=2×0.015mol=0.03mol,m(KClO3)=0.03mol×122.5g/mol=3.675g;
n(Cl2)=n(I2)=0.015mol,氯气体积=0.015mol×22.4L/mol=336mL,
故答案为:3.675;336;
(2)溶液中含有碘酸,碘酸能和KOH溶液反应生成碘酸钾,提高碘酸钾的产率,
故答案为:将KIO3•HIO3转变为KIO3;
(3)根据表中数据知,温度越低,碘酸钙的溶解度越小,则得到的碘酸钙固体越多,所以采用冷水浴;
在<32℃得到碘酸钙的六水合物,其化学式为Ca(IO3)2•6H2O,
故答案为:减小Ca(IO3)2在水中的溶解度,使其充分析出;Ca(IO3)2•6H2O;
(4)根据Ca(IO3)2、IO3-+5I-+6H+═3I2+3H2O、I2+2S2O32-═2I-+S4O62-得关系式
IO3-----6S2O32-,
n(Na2S2O3)=0.1000 mol•L-1×12.00mL×10-3L•mL-1=1.200×10-3mol
n(IO3-)=$\frac{1}{3}$n(I2)=$\frac{1}{6}$ n(Na2S2O3)=2.000×10-4mol
m[Ca(IO3)2]=1.000×10-4mol×390g•mol-1=0.039g
样品中m[Ca(IO3)2]=$\frac{250mL}{50mL}$×0.039g=0.195g,
碘酸钙质量分数=$\frac{0.195g}{0.6000g}$×100%=32.5%,
答:碘酸钙的质量分数为32.5%.
点评 本题考查物质制备,为高频考点,涉及物质制备、方程式的计算,侧重考查学生分析计算及信息获取融合能力,明确各个物理量之间的关系式及物质的性质是解本题关键,题干中信息量大是导致此类试题得分低的重要原因,注意(4)题根据IO3-----6S2O32-计算的碘酸钙并不是样品中所有的碘酸钙,为易错点.

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案| A. | 混合粉末中物质的量之间一定满足:n(Cu)+n(Fe)=n(Fe2O3) | |
| B. | 混合粉末中物质的量之间一定满足:n(Fe)>n(Cu)>n(Fe2O3) | |
| C. | 混合粉末中物质的量之间一定满足:n(Cu)+n(Fe)═n(Fe2O3)+$\frac{bL}{22.4L•mo{l}^{-1}}$ | |
| D. | 若a=72.50,b=1.12,则20.40g混合粉末中:n(Fe)=n(Cu)=0.05mol、n(Fe2O3)=0.09mol |
已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
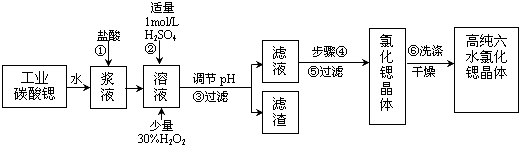
(1)操作①中碳酸锶与盐酸反应的离子方程式SrCO3+2H+=Sr2++CO2↑+H2O.
(2)在步骤②-③的过程中,将溶液的pH值由1调节至B;宜用的试剂为E.
A.1.5 B.3.7 C.9.7
D氨水 E氢氧化锶粉末 F碳酸钠晶体
(3)操作②中加入H2O2发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4(填化学式).
(5)工业上用热风吹干六水氯化锶,适宜的温度是A.
A.50~60℃B.80~100℃C.100℃以上
(6)步骤⑥宜选用的无机洗涤剂是饱和氯化锶溶液.
| A. | 推广使用含磷洗涤剂 | B. | 用O3替代Cl2作饮用水消毒剂 | ||
| C. | 用工业污水直接灌溉农田 | D. | 含CuSO4的废水直接排放 |
 ;
;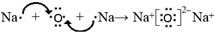 ;
;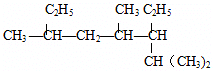 名称:2,4,6-三甲基-3-乙基辛烷
名称:2,4,6-三甲基-3-乙基辛烷 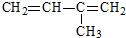 名称:2-甲基-1,3-丁二烯
名称:2-甲基-1,3-丁二烯
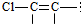 结构的有4种
结构的有4种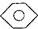 和
和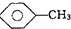 :KMnO4(H+)溶液.
:KMnO4(H+)溶液.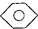 ,
,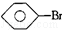 和C6H12(已烯):溴水.
和C6H12(已烯):溴水.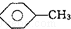 ,CCl4和乙醇:水.
,CCl4和乙醇:水.