题目内容
11.请回答下列问题:25℃时,浓度均为0.10mol•L-1的 ①氨水 ②NH4Cl溶液(1)NH4Cl溶液显酸性,原因是(用离子方程式表示)NH4++H2O?NH3•H2O+H+,若加入少量的氨水,使溶液中c(NH4+)=c(Cl-),则溶液的pH=7 (填“>”、“<”或“=”).
(2)氨水显碱性的原因(用离子方程式表示)NH3•H2O?NH4++OH-,向氨水中加入NH4Cl固体,氨水的电离程度减小(填“增大”、“减小”或“不变”),溶液的pH将减小(填“增大”、“减小”或“不变”).
(3)Mg(OH)2浊液中存在Mg(OH)2的溶解平衡,可表示为(用离子方程式表示)Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),向此浊液中加入浓的NH4Cl溶液,观察到的现象是沉淀溶解.
(4)用离子方程式解释下列事实
①盛NaF溶液要用塑料瓶而不能用玻璃瓶F-+H2O?HF+OH-;4HF+SiO2═SiF4↑+2H2O
②盛纯碱溶液的试剂瓶用橡胶塞而不能用玻璃塞CO32-+H2O?HCO3-+OH-;2OH-+SiO2═SiO32-+H2O.
分析 (1)氯化铵溶液中因为铵根离子的水解,使溶液显酸性,加入氨水导致c(NH4+)=c(Cl-),据电荷守恒分析其pH;
(2)氨水显碱性,是因为一水合氨能够微弱电离生成氢氧根离子;一水合氨是弱碱,存在电离平衡,增大铵根离子浓度时,平衡逆向移动,溶液碱性减弱;
(3)沉淀溶解平衡方程式书写时注意标明各物质的状态,一水合氨比氢氧化镁更难电离,所以向Mg(OH)2浊液中加入浓的NH4Cl溶液,沉淀溶解;
(4)①NaF在溶液中水解生成HF,二氧化硅能溶于HF;
②碳酸钠水解显碱性,玻璃中的二氧化硅与氢氧根离子反应生成硅酸钠.
解答 解:(1)氯化铵溶液中因为铵根离子的水解,使溶液显酸性,铵根水解的离子方程式为NH4++H2O?NH3•H2O+H+,加入氨水导致c(NH4+)=c(Cl-),据电荷守恒则有氢离子浓度与氢氧根离子浓度相等,都是10-7mol/L,pH=7,故答案为:酸性;NH4++H2O?NH3•H2O+H+;=;
(2)氨水显碱性,是因为一水合氨能够微弱电离生成氢氧根离子,电离方程式为NH3•H2O?NH4++OH-,一水合氨是弱碱,存在电离平衡,增大铵根离子浓度时,平衡逆向移动,氨水的电离程度减小,溶液碱性减弱,pH减小;故答案为:NH3•H2O?NH4++OH-;减小;减小;
(3)Mg(OH)2的溶解平衡方程式为Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),向Mg(OH)2浊液中加入浓的NH4Cl溶液,一水合氨比氢氧化镁更难电离,所以铵根离子会结合氢氧根离子生成一水合氨,促使氢氧化镁逐渐溶解,离子方程式为 Mg(OH)2(s)+2 NH4+═Mg2++2NH3•H2O,
故答案为:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq);沉淀溶解;
(4)①NaF在溶液中水解生成HF,其水解方程式为:F-+H2O?HF+OH-;玻璃中的二氧化硅能溶于HF,其反应为:4HF+SiO2═SiF4↑+2H2O;
故答案为:F-+H2O?HF+OH-;4HF+SiO2═SiF4↑+2H2O;
②碳酸钠水解显碱性CO32-+H2O?HCO3-+OH-,玻璃中的二氧化硅与氢氧根离子反应生成硅酸根离子2OH-+SiO2═SiO32-+H2O,
故答案为:CO32-+H2O?HCO3-+OH- 2OH-+SiO2═SiO32-+H2O.
点评 本题考查了弱电解质电离方程式书写、电离平衡的移动、盐类水解、沉淀转化,题目难度不大,注意沉淀溶解平衡方程式书写与弱电解质电离平衡方程式书写的区别.

| A. | Cl- 和NO3-一定来自不同的工厂 | B. | SO42- 和NO3-可能来自同一工厂 | ||
| C. | Ag+ 和Na+ 可能来自同一工厂 | D. | Na+ 和NO3-一定来自同一工厂 |
| A. | 用托盘天平称取15.80g NaCl固体 | |
| B. | 用10mL量筒量取6.25 mL稀硝酸 | |
| C. | 用精密pH试纸测得某溶液的pH为4.2 | |
| D. | 做中和滴定实验时,用50mL规格的酸式滴定管去取17.90mL的烧碱溶液 |
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | H2S溶液无法制取H2SO4 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸中,铁丝在浓硫酸中先反应完 |
| C | 离子反应总是向着某种离子浓度减小的方向进行 | 反应2Na+2CH3COOH═2Na++2CH3COO-+H2↑不能进行 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | MgCO3沉淀在水中煮沸,最终转化为Mg(OH)2沉淀 |
| A. | A | B. | B | C. | C | D. | D |
 A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题: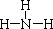 ,写出甲与足量的氢氧化钠溶液反应的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,验证溶液丁中产物阴离子的实验方法为取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2.
,写出甲与足量的氢氧化钠溶液反应的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,验证溶液丁中产物阴离子的实验方法为取少量溶液丁于试管中,逐滴加入稀盐酸,若先产生白色沉淀后消失,说明为NaAlO2. 布洛芬具有解热镇痛作用,常规剂量使用时,不良反应发生率低,是国内外包括世界卫生组织公认的用于小儿发热的经典解热镇痛药.布洛芬的结构简式如图:
布洛芬具有解热镇痛作用,常规剂量使用时,不良反应发生率低,是国内外包括世界卫生组织公认的用于小儿发热的经典解热镇痛药.布洛芬的结构简式如图: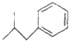 $→_{AlCl_{3}}^{CH_{3}COCl}$A$\stackrel{H_{2}}{→}$
$→_{AlCl_{3}}^{CH_{3}COCl}$A$\stackrel{H_{2}}{→}$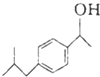 $\stackrel{CO}{→}$布洛芬
$\stackrel{CO}{→}$布洛芬 +
+ $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$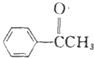 +HCl,请写出A的结构简式
+HCl,请写出A的结构简式

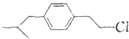 为原料合成布洛芬(用合成路线流程图表示;无机原料任选,并注明反应条件).
为原料合成布洛芬(用合成路线流程图表示;无机原料任选,并注明反应条件). .
.