题目内容
20.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | H2S溶液无法制取H2SO4 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸中,铁丝在浓硫酸中先反应完 |
| C | 离子反应总是向着某种离子浓度减小的方向进行 | 反应2Na+2CH3COOH═2Na++2CH3COO-+H2↑不能进行 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | MgCO3沉淀在水中煮沸,最终转化为Mg(OH)2沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硫化氢与硫酸铜反应生成硫酸;
B.常温下,Al、Fe遇浓硝酸、浓硫酸发生钝化;
C.钠与水反应较剧烈,乙酸比水更易电离出氢离子;
D.发生沉淀的转化,氢氧化镁更难溶.
解答 解:A.硫化氢与硫酸铜反应生成硫酸,因生成CuS不溶于酸,不能利用较强酸可以制取较弱酸解释,故A错误;
B.常温下,Al、Fe遇浓硝酸、浓硫酸发生钝化,与稀酸反应时浓度稍大时反应速率加快,故B错误;
C.钠与水反应较剧烈,乙酸比水更易电离出氢离子,则反应2Na+2CH3COOH═2Na++2CH3COO-+H2↑能进行,故C错误;
D.MgCO3沉淀在水中煮沸,最终转化为Mg(OH)2沉淀发生沉淀的转化,氢氧化镁更难溶,规律合理,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、相关反应原理为解答的关键,侧重分析与实验评价能力的考查,综合性较强,题目难度不大.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
10.常温下,在指定环境中,下列各组离子一定可以大量共存的是( )
| A. | 使甲基橙呈红色的溶液中:Fe2+、Na+、ClO-、SO42- | |
| B. | 在PH=3的溶液中:Mg2+、Al3+、NO3-、Cl- | |
| C. | 由水电离出的c(H+)=10-13mol•L-1的溶液中:Na+、SO32-、AlO2-、Br- | |
| D. | 加入铝粉后产生大量氢气的溶液中:NH4+、K+、NO3-、MnO4- |
5.下列选项实验操作、现象、结论都正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 加热蒸干TiCl4溶液 | 产生大量固体 | 固体成分为TiCl4 |
| B | 用双氧水滴定KI淀粉溶液 | 溶液变蓝 | 达到滴定终点 |
| C | 将K3[Fe(CN)6]溶液滴加到某溶液中 | 产生蓝色沉淀 | 该溶液中含有Fe2+ |
| D | 将SO2通入石蕊溶液中 | 溶液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
4. 碳、硼、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
碳、硼、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
(1)真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+2AlCl3(g)+6C(s)═6AlCl(g)+6CO(g)△H=a kJ•mol-1
②3AlCl(g)═2Al(l)+AlCl3(g)△H=b kJ•mol-1
反应:Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=0.5a+bkJ•mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①0~10min内,NO的平均反应速率v(NO)=0.032mol/(L•min),
T1℃时,该反应的平衡常数=0.25.
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号)AD
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
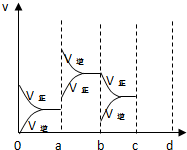
(3)如图表示在密闭容器中反应2SO2+O2?2SO3达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况.
①ab过程中改变的条件可能是:升高温度.
②bc过程中改变的条件可能是:降低产物SO3浓度.
③若增大压强时,反应速率变化情况画在c~d处.
 碳、硼、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
碳、硼、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.(1)真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+2AlCl3(g)+6C(s)═6AlCl(g)+6CO(g)△H=a kJ•mol-1
②3AlCl(g)═2Al(l)+AlCl3(g)△H=b kJ•mol-1
反应:Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=0.5a+bkJ•mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间/min 浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
T1℃时,该反应的平衡常数=0.25.
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号)AD
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)如图表示在密闭容器中反应2SO2+O2?2SO3达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况.
①ab过程中改变的条件可能是:升高温度.
②bc过程中改变的条件可能是:降低产物SO3浓度.
③若增大压强时,反应速率变化情况画在c~d处.
1.在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是( )
| A. | NaOH溶液 | B. | 氨水 | C. | AgNO3溶液 | D. | KSCN溶液 |
2.下列化学用语正确的是( )
| A. | 氯化钠的电子式: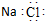 | |
| B. | 苯的结构简式:C6H6 | |
| C. | 硅的原子结构示意图: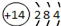 | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42- |
 .
.