题目内容
13.(1)下列物质中能导电的是②⑧,属于强电解质的是①②⑤,①H2SO4,②熔融硫酸钠,③NH3•H2O,④CO2,⑤碳酸钙,⑥CH3COOH,⑦氯气,⑧石墨.
(2)某温度下,将50mL 0.2mol/L MgCl2溶液与50mL 0.2mol/LNaOH溶液充分混合.经判断:有(选填有或无)沉淀生成,依据是QC=0.1mol/L×0.12mol2/L2=1×10-3mol3/L3>KSP已知此温度下(KSP[Mg(OH)2]=1.8×10-12)
(3)常温下,0.lmol•L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)>c(CO32-)(填“>”、“=或“<”),原因是HCO3-水解大于其电离(用恰当的化学用语和必要的文字说明回答).
分析 (1)水溶液中完全电离的电解质为强电解质,存在自由移动的电子、溶液或熔融状态下,含有自由移动离子的可以导电;
(2)1)根据溶液中c(Mg2+)×c(OH-)2与KSP[Mg(OH)2]的相对大小判断;
(3)0.1mol•L-1NaHCO3 溶液的pH大于8,溶液显碱性,水解大于其电离.
解答 解:(1)②熔融硫酸钠含有自由移动离子能导电,⑧石墨能导电;①H2SO4,②熔融硫酸钠,⑤碳酸钙是可以在水溶液中完全电离的电解质,属于强电解质,
故答案为:②⑧;①②⑤;
(2)将50mL 0.2mol/L MgCl2溶液与50mL 0.2mol/L NaOH溶液充分混合,混合后c(Mg2+)=0.1mol/L,c(OH-)=0.1mol/L,则溶液中c(Mg2+)×c(OH-)2=0.1×0.12=10-3>KSP[Mg(OH)2]=1.8×10-12,所以有沉淀生成;
故答案为:有; QC=0.1mol/L×0.12mol2/L2=1×10-3mol3/L3>KSP;
(3)0.1mol•L-1NaHCO3 溶液的pH大于8,溶液显碱性,水解大于其电离,则c(HCO3-)>c(CO3 2-),故答案为:>;HCO3-水解大于其电离.
点评 本题考查了强电解质、导电性的分析判断、溶液中离子浓度的求算,侧重于Ksp的应用的考查,主要是概念理解应用,物质组成和性质是解题关键,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
4. 碳、硼、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
碳、硼、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
(1)真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+2AlCl3(g)+6C(s)═6AlCl(g)+6CO(g)△H=a kJ•mol-1
②3AlCl(g)═2Al(l)+AlCl3(g)△H=b kJ•mol-1
反应:Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=0.5a+bkJ•mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①0~10min内,NO的平均反应速率v(NO)=0.032mol/(L•min),
T1℃时,该反应的平衡常数=0.25.
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号)AD
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
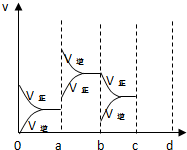
(3)如图表示在密闭容器中反应2SO2+O2?2SO3达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况.
①ab过程中改变的条件可能是:升高温度.
②bc过程中改变的条件可能是:降低产物SO3浓度.
③若增大压强时,反应速率变化情况画在c~d处.
 碳、硼、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
碳、硼、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.(1)真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+2AlCl3(g)+6C(s)═6AlCl(g)+6CO(g)△H=a kJ•mol-1
②3AlCl(g)═2Al(l)+AlCl3(g)△H=b kJ•mol-1
反应:Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=0.5a+bkJ•mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间/min 浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
T1℃时,该反应的平衡常数=0.25.
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号)AD
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)如图表示在密闭容器中反应2SO2+O2?2SO3达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况.
①ab过程中改变的条件可能是:升高温度.
②bc过程中改变的条件可能是:降低产物SO3浓度.
③若增大压强时,反应速率变化情况画在c~d处.
1.在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂是( )
| A. | NaOH溶液 | B. | 氨水 | C. | AgNO3溶液 | D. | KSCN溶液 |
8.参看表格内容,回答下列问题:
(1)X、Y、Z、F分别是(写名称)碳、硫、钠、过氧化钠.
(2)G中的化学键有(填“有”或“没有”)极性.G在固态时属于分子晶体
(3)Y和Z直接作用后的生成物属于离子晶体.写出它的电子式 .
.
| 物质 | 外观 | 在空气中加热时的现象 | 产物水溶液的酸碱性 |
| X | 黑色粉未 | 燃烧时呈炽红色并发出火花,放出无色气体G | 微弱酸性 |
| Y | 淡黄色晶体 | 首先熔化,然后燃烧,火焰为浅蓝色,放出有刺激性气味的气体 | 弱酸性 |
| Z | 银白色固体 | 燃烧,产生黄色火焰,生成浅黄色固体F | 强碱性 |
(2)G中的化学键有(填“有”或“没有”)极性.G在固态时属于分子晶体
(3)Y和Z直接作用后的生成物属于离子晶体.写出它的电子式
 .
.
18.2SO2(g)+O2(g)═2SO3(g)△H<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡,下列说法正确的是( )
| A. | 甲和乙中反应的化学平衡常数相同 | |
| B. | 乙和丙中的二氧化硫的生成速率相同 | |
| C. | 乙中SO3的体积分数大于丙 | |
| D. | 转化率:α甲(SO2)+α乙(SO3)<1 |
2.下列化学用语正确的是( )
| A. | 氯化钠的电子式: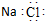 | |
| B. | 苯的结构简式:C6H6 | |
| C. | 硅的原子结构示意图: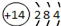 | |
| D. | 硫酸的电离方程式:H2SO4═H2++SO42- |
3.下列对化学反应本质的认识,错误的是( )
| A. | 原子一定重新组合 | B. | 一定有电子转移 | ||
| C. | 有旧键断裂和新键形成 | D. | 必然伴随着能量的变化 |
 ;
;