题目内容
1. A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:(1)E的基态原子价层电子排布式为3d24s2.
(2)AB2分子中,A的杂化类型为sp;在元素周期表中A、B及与两者紧邻的元素的第一电离能由大到小的顺序为(用元素符号表示)N>O>C.
(3)B的氢化物与D的氢化物的沸点较高的是H2O(用化学式表示),原因是H2O分子之间存在氢键.
(4)AB2形成的晶体的熔点低于(填“高于”“低于”或“无法判断”)CD形成的晶体的熔点,原因是CO2形成的晶体属于分子晶体,NaCl属于离子晶体.
(5)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为TiO2(用元素符号表示).ED4是制取航天航空工业材料的重要原料.取上述橙红色晶体,放在电炉中,通入D2和A的单质后高温加热,可制得ED4,同时产生一种造成温室效应的气体,写出反应的化学方程式:TiO2+C+2Cl2 $\frac{\underline{\;高温\;}}{\;}$TiCl4+CO2.
(6)由C、D两元素形成的化合物组成的晶体中,晶体结构图以及晶胞的剖面图如图所示,若晶胞边长是acm,则该晶体的密度为$\frac{234}{{N}_{A}×{a}^{3}}$g/cm3.(已知阿伏加德罗常数为NA)
分析 A、B、C、D、E五种常见元素,它们的核电荷数依次增大.其中元素E的基态3d轨道上有2个电子,原子核外电子排布式为1s22s22p63s23p63d24s2,则E为Ti;B是地壳中含量最多的元素,则B为O元素;C是短周期中最活泼的金属元素,则C为Na;D与C可形成CD型离子化合物,则D为Cl;A的基态原子中有2个未成对电子,原子序数小于氧,原子核外电子排布式为1s22s22p2,故A为碳元素,据此解答.
解答 解:A、B、C、D、E五种常见元素,它们的核电荷数依次增大.其中元素E的基态3d轨道上有2个电子,原子核外电子排布式为1s22s22p63s23p63d24s2,则E为Ti;B是地壳中含量最多的元素,则B为O元素;C是短周期中最活泼的金属元素,则C为Na;D与C可形成CD型离子化合物,则D为Cl;A的基态原子中有2个未成对电子,原子序数小于氧,原子核外电子排布式为1s22s22p2,故A为碳元素.
(1)E的基态3d轨道上有2个电子,原子核外电子排布式为1s22s22p63s23p63d24s2,基态原子价层电子排布式为3d24s2,故答案为:3d24s2;
(2)CO2分子结构式为O=C=O,碳原子成2个δ键、没有孤对电子,故C原子采取sp杂化;
同周期随原子序数增大,第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C,故答案为:sp;N>O>C;
(3)H2O分子之间存在氢键,沸点高于HCl的,故答案为:H2O;H2O分子之间存在氢键;
(4)CO2形成的晶体属于分子晶体,NaCl属于离子晶体,通常情况下,离子晶体熔点大于分子晶体熔点,故CO2形成的晶体的熔点低于NaCl,故答案为:低于;CO2形成的晶体属于分子晶体,NaCl属于离子晶体;
(5)该晶胞中Ti原子个数=1+8×$\frac{1}{8}$=2、O原子个数=2+4×$\frac{1}{2}$=4,则Ti、O原子个数之比=2:4=1:2,则化学式为TiO2,
TiCl4是制取航天航空工业材料的重要原料.取上述橙红色晶体,放在电炉中,通入Cl2和碳的单质后高温加热,可制得TiCl4,同时产生一种造成温室效应的气体,该气体为二氧化碳,该反应的化学方程式为:TiO2+C+2Cl2 $\frac{\underline{\;高温\;}}{\;}$TiCl4+CO2,
故答案为:TiO2;TiO2+C+2Cl2 $\frac{\underline{\;高温\;}}{\;}$TiCl4+CO2;
(6)由晶胞结构可知,Na+为黑球,Cl-为白球,晶胞中Na+离子数目=1+12×$\frac{1}{4}$=4,Cl-离子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶胞质量=4×$\frac{58.5}{{N}_{A}}$ g,则该晶体的密度=4×$\frac{58.5}{{N}_{A}}$g÷(acm)3=$\frac{234}{{N}_{A}×{a}^{3}}$ g•cm-3,故答案为:$\frac{234}{{{N_A}•{a^3}}}$.
点评 本题是对物质结构的考查,涉及晶胞计算、杂化轨道、电离能、核外电子排布、晶体性质等,推断元素是解题关键,注意利用均摊法进行晶胞计算.

 阅读快车系列答案
阅读快车系列答案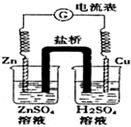
| A. | 随着反应进行,左烧杯中盐溶液浓度上升,右烧杯中酸溶液浓度下降 | |
| B. | 盐桥的作用是让电子通过,以构成闭合回路 | |
| C. | 随着反应进行,右烧杯中溶液pH变小 | |
| D. | 总反应为:2H++Zn═H2↑+Zn2+ |
(1)2P+5CuSO4+8H2O═5Cu+2H3PO4+5H2SO4
(2)11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4
下列说法中正确的是( )
| A. | 在上述两个反应中,当有1molP参加反应时,反应转移电子数均为5NA | |
| B. | 在反应(2)中,当生成3mol硫酸时,被还原的P为1mol | |
| C. | 在上述两个反应中,P均作还原剂 | |
| D. | 在上述两个反应中,还原产物都是H3PO4 |
| A. | NaH中氢离子结构示意图: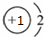 | B. | CH4分子的球棍模型: | ||
| C. | 醛基的电子式: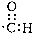 | D. | 对-硝基甲苯的结构简式: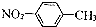 |
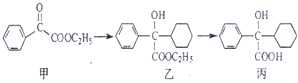
| A. | 化合物甲中的含氧官能团有 羰基和酯基 | |
| B. | 化合物乙与NaOH水溶液在加热条件下反应可生成化合物丙 | |
| C. | 化合物乙中含有1个手性碳原子 | |
| D. | 在NaOH醇溶液中加热,化合物丙可发生消去反应 |
| A. | 使甲基橙呈红色的溶液中:Fe2+、Na+、ClO-、SO42- | |
| B. | 在PH=3的溶液中:Mg2+、Al3+、NO3-、Cl- | |
| C. | 由水电离出的c(H+)=10-13mol•L-1的溶液中:Na+、SO32-、AlO2-、Br- | |
| D. | 加入铝粉后产生大量氢气的溶液中:NH4+、K+、NO3-、MnO4- |