题目内容
铁屑可用于地下水脱氮,实验室研究步骤如下:
Ⅰ、将铁屑浸泡在0.5mol/L盐酸中进行预处理.
Ⅱ、30min后,用去离子水反复冲洗,至冲洗后液体的pH为中性.在N2保护下烘干备用.
Ⅲ、在蒸馏水中加入硝酸钾配制硝酸钾溶液.
Ⅳ、将酸预处理后的铁屑加入硝酸钾溶液中.
请回答:
(1)盐酸溶解Fe2O3的离子方程式是 .
(2)烘干时需要在N2保护下进行的原因是 .
(3)将步骤Ⅱ中冲洗后的溶液在空气中加热蒸发灼烧,最终得到的固体是 .
(4)将酸性条件下,铁与NO3-反应的离子方程式补充完整:
Fe+ NO3-+ ═ Fe2++ NH4++ .
Ⅰ、将铁屑浸泡在0.5mol/L盐酸中进行预处理.
Ⅱ、30min后,用去离子水反复冲洗,至冲洗后液体的pH为中性.在N2保护下烘干备用.
Ⅲ、在蒸馏水中加入硝酸钾配制硝酸钾溶液.
Ⅳ、将酸预处理后的铁屑加入硝酸钾溶液中.
请回答:
(1)盐酸溶解Fe2O3的离子方程式是
(2)烘干时需要在N2保护下进行的原因是
(3)将步骤Ⅱ中冲洗后的溶液在空气中加热蒸发灼烧,最终得到的固体是
(4)将酸性条件下,铁与NO3-反应的离子方程式补充完整:
考点:铁的氧化物和氢氧化物,铁的化学性质
专题:
分析:(1)盐酸与Fe2O3反应生成氯化铁和水;
(2)烘干时需防止铁屑在空气中被氧化;
(3)滤液中含有氯化亚铁,加热促进水解,被氧化生成氢氧化铁,分解生成氧化铁;
(4)铁与氢离子、NO3-反应生成Fe2+、NH4+和水.
(2)烘干时需防止铁屑在空气中被氧化;
(3)滤液中含有氯化亚铁,加热促进水解,被氧化生成氢氧化铁,分解生成氧化铁;
(4)铁与氢离子、NO3-反应生成Fe2+、NH4+和水.
解答:
解:(1)盐酸与Fe2O3反应生成氯化铁和水,离子方程式为Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)烘干时需防止铁屑在空气中被氧化,可用氮气作为保护气,故答案为:防止铁屑在空气中被氧化;
(3)滤液中含有氯化亚铁,加热促进水解,被氧化生成氢氧化铁,分解生成氧化铁,故答案为:Fe2O3;
(4)铁与NO3-反应生成Fe2+、NH4+和水,反应的方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O,故答案为:4;1;10H+;4;1;3H2O.
(2)烘干时需防止铁屑在空气中被氧化,可用氮气作为保护气,故答案为:防止铁屑在空气中被氧化;
(3)滤液中含有氯化亚铁,加热促进水解,被氧化生成氢氧化铁,分解生成氧化铁,故答案为:Fe2O3;
(4)铁与NO3-反应生成Fe2+、NH4+和水,反应的方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O,故答案为:4;1;10H+;4;1;3H2O.
点评:本题考查物质的性质探究,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理、方法和注意事项,难度中等.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
用下列实验装置完成对应的实验,能达到实验目的是( )
A、 用酒精从碘水中萃取碘 |
B、 收集H2或CO2 |
C、 从食盐水中提取NaCl |
D、 石油的分馏 |
有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
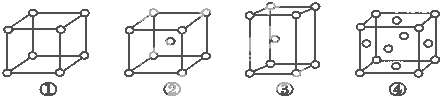

| A、①为简单立方堆积②为六方最密堆积③为体心立方堆积④为面心立方最密堆积 |
| B、每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个 |
| C、晶胞中原子的配位数分别为:①6,②8,③8,④12 |
| D、空间利用率的大小关系为:①<②<③<④ |
有机物HPE: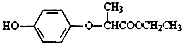 是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )
是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )
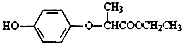 是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )
是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )| A、该有机物的分子式为C11H14O4 |
| B、该有机物具有7种不同化学环境的氢原子 |
| C、该有机物能与NaOH溶液反应,生成3种有机物 |
| D、1mol该有机物完全燃烧,将消耗12.5molO2 |
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3═5N2+6H2O;②6NO2+8NH3═7N2+12H2O;③NO+NO2+2NH3═2N2+3H2O.下列说法正确的是( )
| A、汽车尾气中含有NOx,NOx是引起温室效应的主要气体之一 |
| B、N2中π键与σ键之比为1:2 |
| C、反应③中每生成标况下的22.4 L N2转移电子数1.5NA |
| D、NH3的沸点比PH3的沸点高 |
已知:①Na3N+3H2O═3NaOH+NH3↑,②NaH+H2O═NaOH+H2↑下列叙述正确的是( )
| A、离子半径:N3->Na+>H+ |
| B、反应①和②都是氧化还原反应 |
| C、反应①和②氧化剂都是H2O |
| D、Na3N和NaH与盐酸反应都只生成一种盐 |
