题目内容
①同温、同压下,质量相等的SO2和CO2相比较,体积之比为 ,
已知SO2和CO2均为酸性氧化物,写出CO2与足量NaOH溶液反应的离子方程式 ;
②某溶液中可能含有大量下列阴离子:OH-、SO42-、CO32-、Cl-.
(1)当溶液中存在大量H+时,则溶液中不可能有 .
(2)当溶液中有大量的Ba2+存在时,则溶液中不可能有 ,用离子方程式写出不可能存在的原因 、 .
已知SO2和CO2均为酸性氧化物,写出CO2与足量NaOH溶液反应的离子方程式
②某溶液中可能含有大量下列阴离子:OH-、SO42-、CO32-、Cl-.
(1)当溶液中存在大量H+时,则溶液中不可能有
(2)当溶液中有大量的Ba2+存在时,则溶液中不可能有
考点:离子共存问题,离子方程式的书写,物质的量的相关计算
专题:
分析:①根据V=nVm=
Vm可知,等质量的气体在相同条件下体积之比与摩尔质量成反比;
氢氧化钠足量,二氧化碳与氢氧化钠溶液反应生成碳酸钠和水;
②(1)溶液中存在大量氢离子,与氢离子反应的离子不能大量共存;
(2)溶液中存在大量钡离子,则与钡离子反应的离子不能共存;钡离子与硫酸根离子、碳酸根离子反应生成硫酸钡、碳酸钡沉淀.
| m |
| M |
氢氧化钠足量,二氧化碳与氢氧化钠溶液反应生成碳酸钠和水;
②(1)溶液中存在大量氢离子,与氢离子反应的离子不能大量共存;
(2)溶液中存在大量钡离子,则与钡离子反应的离子不能共存;钡离子与硫酸根离子、碳酸根离子反应生成硫酸钡、碳酸钡沉淀.
解答:
解:①同温、同压下,根据V=nVm=
Vm可知,质量相等的SO2和CO2相比较,体积之比与其摩尔质量成反比,所以二者的体积之比为:44g/mol:64g/mol=11:16;
CO2与足量NaOH溶液反应生成碳酸钠和水,反应的离子方程式为:CO2+2OH-=CO32-+H2O,
故答案为:11:16;CO2+2OH-=CO32-+H2O;
②当溶液中存在大量H+时,OH-、CO32-与H+反应,在溶液中不能共存;
当溶液中有大量的Ba2+存在时,Ba2+与SO42-、CO32-发生反应:Ba2++SO42-=BaSO4、Ba2++CO32-=BaCO3,在溶液中不能大量共存,
故答案为:OH-、CO32-;Ba2++SO42-=BaSO4;Ba2++CO32-=BaCO3.
| m |
| M |
CO2与足量NaOH溶液反应生成碳酸钠和水,反应的离子方程式为:CO2+2OH-=CO32-+H2O,
故答案为:11:16;CO2+2OH-=CO32-+H2O;
②当溶液中存在大量H+时,OH-、CO32-与H+反应,在溶液中不能共存;
当溶液中有大量的Ba2+存在时,Ba2+与SO42-、CO32-发生反应:Ba2++SO42-=BaSO4、Ba2++CO32-=BaCO3,在溶液中不能大量共存,
故答案为:OH-、CO32-;Ba2++SO42-=BaSO4;Ba2++CO32-=BaCO3.
点评:本题考查了离子共存、离子方程式书写、有关物质的量的计算,题目难度中等,注意掌握离子反应发生条件,明确离子共存的判断方法及离子方程式的书写原则,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
人类的生活离不开材料,
①塑料广泛应用与生产、生活的各个领域,聚乙烯塑料属于 (填序号)
A.有机高分子材料 B.无机非金属材料 C.金属材料
②蚕丝、尼龙、棉花这三种常见的纤维中,主要成分为蛋白质的是 .
①塑料广泛应用与生产、生活的各个领域,聚乙烯塑料属于
A.有机高分子材料 B.无机非金属材料 C.金属材料
②蚕丝、尼龙、棉花这三种常见的纤维中,主要成分为蛋白质的是
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3═5N2+6H2O;②6NO2+8NH3═7N2+12H2O;③NO+NO2+2NH3═2N2+3H2O.下列说法正确的是( )
| A、汽车尾气中含有NOx,NOx是引起温室效应的主要气体之一 |
| B、N2中π键与σ键之比为1:2 |
| C、反应③中每生成标况下的22.4 L N2转移电子数1.5NA |
| D、NH3的沸点比PH3的沸点高 |
下列离子方程式的书写正确的是( )
| A、氢氧化钡和稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、铜片跟稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
| C、醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
| D、硫酸亚铁溶液与过氧化氢溶液混合:2Fe2++H2O2+2H+═2Fe3++2H2O |
 含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O.
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O. ④HCHO等,
④HCHO等,
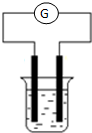 现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下:
现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下: