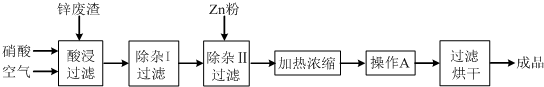
题目内容
下列离子反应方程式正确的是( )
| A、FeBr2中通入一定量Cl2:2Fe2++2Br-+2Cl2═4Cl-+Br2+2Fe3+ |
| B、少量SO2通入Ca(ClO)2溶液中:SO2+Ca2++2ClO-+H2O═CaSO3↓+2HClO |
| C、NaHCO3溶液中滴加NaOH溶液:HCO3-+OH-═H2O+CO2↑ |
| D、NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
考点:离子方程式的书写
专题:
分析:A.氯气有强氧化性,能氧化亚铁离子和溴离子;
B.次氯酸能够氧化亚硫酸根离子;
C.NaHCO3与NaOH溶液反应实质为碳酸氢根离子与氢氧根离子反应生成碳酸根离子和水;
D.离子个数不符合物质的配比.
B.次氯酸能够氧化亚硫酸根离子;
C.NaHCO3与NaOH溶液反应实质为碳酸氢根离子与氢氧根离子反应生成碳酸根离子和水;
D.离子个数不符合物质的配比.
解答:
解:A.氯气有强氧化性,能氧化亚铁离子和溴离子,方程式:2Fe2++2Br-+2Cl2═4Cl-+Br2+2Fe3+,故A正确;
B.向次氯酸钙溶液中通入过量的二氧化硫,亚硫酸盐不可能存在次氯酸溶液中,要发生氧化还原反应,正确的离子方程式为2ClO-+Ca2++2H2O+2SO2=2Cl-+CaSO4↓+4H++SO42-,故B错误;
C.NaHCO3与NaOH溶液反应实质为碳酸氢根离子与氢氧根离子反应生成碳酸根离子和水,离子方程式为:OH-+HCO3-=CO32-+H2O,故C正确;
D.向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性,离子方程式为:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O,故D错误.
故选AC.
B.向次氯酸钙溶液中通入过量的二氧化硫,亚硫酸盐不可能存在次氯酸溶液中,要发生氧化还原反应,正确的离子方程式为2ClO-+Ca2++2H2O+2SO2=2Cl-+CaSO4↓+4H++SO42-,故B错误;
C.NaHCO3与NaOH溶液反应实质为碳酸氢根离子与氢氧根离子反应生成碳酸根离子和水,离子方程式为:OH-+HCO3-=CO32-+H2O,故C正确;
D.向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性,离子方程式为:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O,故D错误.
故选AC.
点评:本题考查离子反应的书写,明确发生的化学反应是解答本题的关键,注意发生的氧化还原反应为解答的难点,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
SCR法(选择性催化还原技术)是一种以NH3作为还原剂,将烟气中NOx分解成无害的N2和H2O的干法脱硝技术,反应原理为:①6NO+4NH3═5N2+6H2O;②6NO2+8NH3═7N2+12H2O;③NO+NO2+2NH3═2N2+3H2O.下列说法正确的是( )
| A、汽车尾气中含有NOx,NOx是引起温室效应的主要气体之一 |
| B、N2中π键与σ键之比为1:2 |
| C、反应③中每生成标况下的22.4 L N2转移电子数1.5NA |
| D、NH3的沸点比PH3的沸点高 |
已知:①Na3N+3H2O═3NaOH+NH3↑,②NaH+H2O═NaOH+H2↑下列叙述正确的是( )
| A、离子半径:N3->Na+>H+ |
| B、反应①和②都是氧化还原反应 |
| C、反应①和②氧化剂都是H2O |
| D、Na3N和NaH与盐酸反应都只生成一种盐 |
用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
| A、常温常压下,3.36L氯气与2.7g铝充分反应转移的电子数小于0.3NA |
| B、标准状况下,5.6L O2作氧化剂时转移电子数一定为NA |
| C、0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA |
| D、80g CuO和Cu2S的混合物含有铜原子数一定为NA |
下列离子方程式的书写正确的是( )
| A、氢氧化钡和稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、铜片跟稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
| C、醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
| D、硫酸亚铁溶液与过氧化氢溶液混合:2Fe2++H2O2+2H+═2Fe3++2H2O |
下列各物质中物质的量最多的是(NA表示阿伏伽德罗常数)( )
| A、1 mol CO2 |
| B、标准状况下44.8 L H2 |
| C、3 NA 个水分子 |
| D、1 L 1 mol/L的硫酸钠溶液中所含的溶质 |