题目内容
室温下,现有三种酸,a盐酸、b乙酸、c硫酸的稀溶液,下列说法正确的是( )
| A、同浓度,pH由大到小:c>a>b |
| B、同浓度同体积,分别与氢氧化钠中和,所需的氢氧化钠的物质的量由大到小:c>a>b |
| C、同pH,物质的量浓度由大到小:b>a>c |
| D、同pH同体积,分别于少量且质量相同的Zn片反应,反应所需时间由长到短:b>a>c |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.同浓度时,氢离子浓度大小顺序是c>a>b,氢离子浓度越大其pH越小;
B.同浓度同体积时,消耗氢氧化钠的物质的量与氢离子的物质的量成正比;
C.同pH时,相同元数的酸,酸的电离程度越大其浓度越小,强酸溶液中,酸的浓度与元数成反比;
D.同pH同体积,分别于少量且质量相同的Zn片反应,反应过程中,氢离子浓度越大其反应速率越大.
B.同浓度同体积时,消耗氢氧化钠的物质的量与氢离子的物质的量成正比;
C.同pH时,相同元数的酸,酸的电离程度越大其浓度越小,强酸溶液中,酸的浓度与元数成反比;
D.同pH同体积,分别于少量且质量相同的Zn片反应,反应过程中,氢离子浓度越大其反应速率越大.
解答:
解:A.同浓度时,氢离子浓度大小顺序是c>a>b,氢离子浓度越大其pH越小,则pH大小顺序是b>a>c,故A错误;
B.同浓度同体积时,消耗氢氧化钠的物质的量与氢离子的物质的量成正比,硫酸消耗氢氧化钠最多,醋酸和盐酸物质的量相等且都是一元酸,所以二者消耗NaOH的物质的量相等,则所需的氢氧化钠的物质的量由大到小:c>a=b,故B错误;
C.同pH时,相同元数的酸,酸的电离程度越大其浓度越小,强酸溶液中,酸的浓度与元数成反比,所以pH相等的这三种酸,其物质的量浓度大小关系为b>a>c,故C正确;
D.同pH同体积,分别于少量且质量相同的Zn片反应,反应过程中,氢离子浓度越大其反应速率越大,随着反应的进行,醋酸中氢离子浓度最大,盐酸和硫酸中氢离子浓度相等,所以反应速率大小顺序是b>a=c,反应所需时间由长到短:b<a=c,故D错误;
故选C.
B.同浓度同体积时,消耗氢氧化钠的物质的量与氢离子的物质的量成正比,硫酸消耗氢氧化钠最多,醋酸和盐酸物质的量相等且都是一元酸,所以二者消耗NaOH的物质的量相等,则所需的氢氧化钠的物质的量由大到小:c>a=b,故B错误;
C.同pH时,相同元数的酸,酸的电离程度越大其浓度越小,强酸溶液中,酸的浓度与元数成反比,所以pH相等的这三种酸,其物质的量浓度大小关系为b>a>c,故C正确;
D.同pH同体积,分别于少量且质量相同的Zn片反应,反应过程中,氢离子浓度越大其反应速率越大,随着反应的进行,醋酸中氢离子浓度最大,盐酸和硫酸中氢离子浓度相等,所以反应速率大小顺序是b>a=c,反应所需时间由长到短:b<a=c,故D错误;
故选C.
点评:本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,知道溶液pH与其浓度、电解质强弱的关系,注意不同酸与同一金属反应时,反应速率与氢离子浓度有关而与电解质强弱无关,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
有Fe2+、NO3-、Fe3+、NH4+、H2O和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A、氧化剂与还原剂的物质的量之比为1:8 |
| B、还原产物为NH4+ |
| C、若有1 mol NO3-参加氧化反应,则转移8 mol电子 |
| D、该过程说明Fe(NO3)2溶液不宜加酸酸化 |
下列叙述中正确的是( )
| A、常温常压下,28 g氮气所含的原子数为2NA |
| B、1 mol氯化氢约含有6.02×1023个粒子 |
| C、22.4 L甲烷(CH4)所含的原子数为5 NA |
| D、2.4 g镁原子变成离子时,失去的电子数为0.3 NA |
四个电解装置都以Pt作电极,它们分别装着如下电解质溶液进行电解,电解一段时间后,测定其pH变化,所记录的结果正确的是( )
| A | B | C | D | |
| 电解质溶液 | HCl | AgNO3 | KOH | BaCl2 |
| pH变化 | 减小 | 增大 | 增大 | 不变 |
| A、A | B、B | C、C | D、D |
以1一氯丙烷为主要原料,制取1,2-丙二醇时,需要经过的各反应分别为( )
| A、加成-消去-取代 |
| B、消去-加成-取代 |
| C、取代-消去-加成 |
| D、取代-加成-消去 |
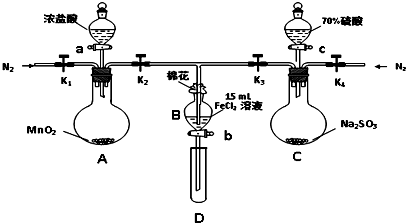
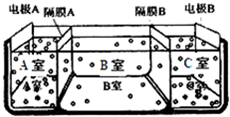 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题: