题目内容
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:(1)水质优劣直接影响人体健康.天然水在净化处理过程中加入的混凝剂可以是
(2)水的净化与软化的区别是
(3)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO).若某天然水中c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为
(4)若(3)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2
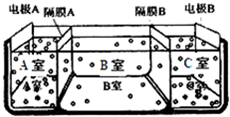
(5)如图是电渗析法淡化海水的原理图,其中,电极A接直流电源的正极,电极B接直流电源的负极.
①隔膜A是
②某种海水样品,经分析含有大量的Na+、Cl-,以及少量的K+、SO42-.若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为
考点:海水资源及其综合利用,原电池和电解池的工作原理,难溶电解质的溶解平衡及沉淀转化的本质
专题:电化学专题,元素及其化合物
分析:(1)混凝剂是溶液中水解生成胶体的盐类,净水作用是吸附悬浮杂质使其聚沉达到净化目的;
(2)净化水是除去悬浮杂质,软化水是除去钙镁离子;
(3)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(4)硬水软化需要把钙离子和镁离子全部沉淀,加入氢氧化钙和镁离子、碳酸氢根离子反应,加入碳酸钠沉淀钙离子.;
(5)阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;电解池的阴极是氢离子放电,阳极是氢氧根离子放电;根据电极反应来书写总的电解反应;
(2)净化水是除去悬浮杂质,软化水是除去钙镁离子;
(3)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(4)硬水软化需要把钙离子和镁离子全部沉淀,加入氢氧化钙和镁离子、碳酸氢根离子反应,加入碳酸钠沉淀钙离子.;
(5)阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;电解池的阴极是氢离子放电,阳极是氢氧根离子放电;根据电极反应来书写总的电解反应;
解答:
解:(1)混凝剂是吸附水中的微小悬浮颗粒,凝聚成较大的颗粒,而快速沉降的主要作用,要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,如明矾,铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,所以能净水,水解方程式为Al3++3H2O?Al(OH)3+3H+,明矾,硫酸铝,硫酸铁,硫酸亚铁也可以起到净水的作用,铝盐或铁盐在水中发生水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉达到净水的目的;
故答案为:明矾,硫酸铝,硫酸铁,硫酸亚铁,铝盐或铁盐在水中发生水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉达到净水的目的;
(2)水的净化是除去悬浮性杂质,一般用明矾进行;水的软化是降低Ca2+、Mg2+的浓度,方法很多,有离子交换法、石灰纯碱法等,
故答案为:水的净化是用混凝剂(如明矾等)将水中胶体及悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子;
(3)某天然水中c(Ca2+)=1.2×10-3mol?L-1,c(Mg2+)=6×10-4mol?L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,所以水的硬度=
=10°;
故答案为:10°;
(4)10m3这种天然水水中含有钙离子物质的量=10×103L×1.2×10-3mol?L-1=12mol;镁离子物质的量=10×103L×6×10-4mol?L-1=6mol;碳酸氢根离子物质的量=10×103L×8×10-4mol?L-1=8mol;加入氢氧化钙发生的反应为:
Mg2++2OH-=Mg(OH)2↓ HCO3-+OH-=CO32-+H2O
1 2 1 1 1
6mol 12mol 8mol 8mol 8mol
共需氢氧根物质的量20mol;
需要Ca(OH)2物质的量10mol,氢氧化钙质量为74g/mol×10mol=740g,
水溶液中Ca2+物质的量为12mol+10mol=22mol,
其中需要加入的 碳酸根离子为22mol-8mol=14mol,需要碳酸钠的质量为14mol×106g/mol=1484g,
故答案为:740;1484;
(5)电解池的阴极是氢离子放电,阳极是氢氧根离子放电,隔膜A是阴离子交换膜,隔膜C是阳离子交换膜,则导致A室显酸性,B室显中性,C室显碱性,所以pH大小顺序为:pHa<pHb<pHc;
故答案为:阴,pHa<pHb<pHc;
故答案为:明矾,硫酸铝,硫酸铁,硫酸亚铁,铝盐或铁盐在水中发生水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉达到净水的目的;
(2)水的净化是除去悬浮性杂质,一般用明矾进行;水的软化是降低Ca2+、Mg2+的浓度,方法很多,有离子交换法、石灰纯碱法等,
故答案为:水的净化是用混凝剂(如明矾等)将水中胶体及悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子;
(3)某天然水中c(Ca2+)=1.2×10-3mol?L-1,c(Mg2+)=6×10-4mol?L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,所以水的硬度=
| 67.2mg |
| 10mg |
故答案为:10°;
(4)10m3这种天然水水中含有钙离子物质的量=10×103L×1.2×10-3mol?L-1=12mol;镁离子物质的量=10×103L×6×10-4mol?L-1=6mol;碳酸氢根离子物质的量=10×103L×8×10-4mol?L-1=8mol;加入氢氧化钙发生的反应为:
Mg2++2OH-=Mg(OH)2↓ HCO3-+OH-=CO32-+H2O
1 2 1 1 1
6mol 12mol 8mol 8mol 8mol
共需氢氧根物质的量20mol;
需要Ca(OH)2物质的量10mol,氢氧化钙质量为74g/mol×10mol=740g,
水溶液中Ca2+物质的量为12mol+10mol=22mol,
其中需要加入的 碳酸根离子为22mol-8mol=14mol,需要碳酸钠的质量为14mol×106g/mol=1484g,
故答案为:740;1484;
(5)电解池的阴极是氢离子放电,阳极是氢氧根离子放电,隔膜A是阴离子交换膜,隔膜C是阳离子交换膜,则导致A室显酸性,B室显中性,C室显碱性,所以pH大小顺序为:pHa<pHb<pHc;
故答案为:阴,pHa<pHb<pHc;
点评:本题考查了盐类水解的应用,净水方法和软化原理,水的硬度计算需要理解题干信息,准确计算,题目难度中等.

练习册系列答案
相关题目
能用离子方程式H++OH-=H2O表示的化学方程式是( )
| A、KOH+CH3COOH=CH3COOK+H2O |
| B、Ba(OH)2+H2SO4=BaSO4↓+2H2O |
| C、Cu(OH)2+H2SO4=CuSO4+2H2O |
| D、2NaOH+H2SO4=Na2SO4+2H2O |
下列说法不正确的是( )
| A、焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应 |
| B、在同一条件下不同物质有不同的熵值,其体系的混乱度越大,熵值越大 |
| C、一个反应能否自发进行取决于反应吸热还是放热 |
| D、一个反应能否自发进行,与焓变和熵变的共同影响结果有关 |
室温下,现有三种酸,a盐酸、b乙酸、c硫酸的稀溶液,下列说法正确的是( )
| A、同浓度,pH由大到小:c>a>b |
| B、同浓度同体积,分别与氢氧化钠中和,所需的氢氧化钠的物质的量由大到小:c>a>b |
| C、同pH,物质的量浓度由大到小:b>a>c |
| D、同pH同体积,分别于少量且质量相同的Zn片反应,反应所需时间由长到短:b>a>c |
