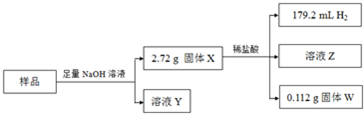
题目内容
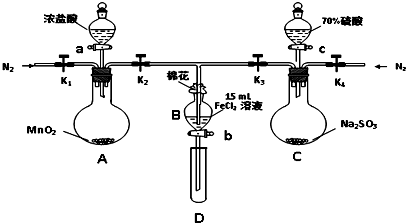
为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,关闭K2.
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是 .
(2)棉花中浸润的溶液为 .
(3)A中发生反应的化学方程式 .
(4)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为 .
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示.他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是 (填“甲”“乙”“丙”).

实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,关闭K2.
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是
(2)棉花中浸润的溶液为
(3)A中发生反应的化学方程式
(4)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示.他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是
| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
考点:氧化性、还原性强弱的比较
专题:实验探究和数据处理题
分析:(1)通入一段时间N2,排出装置中的氧气;
(2)氯气和二氧化硫都是有毒气体,可以用氢氧化钠来吸收;
(3)A中发生二氧化锰与浓盐酸的反应,生成氯化锰、氯气、水;
(4)SO2通入酸性高锰酸钾溶液中二者可以发生氧化还原反应;
(5)溶液显酸性,检验硫酸根离子应选择氯化钡溶液;乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫.
(2)氯气和二氧化硫都是有毒气体,可以用氢氧化钠来吸收;
(3)A中发生二氧化锰与浓盐酸的反应,生成氯化锰、氯气、水;
(4)SO2通入酸性高锰酸钾溶液中二者可以发生氧化还原反应;
(5)溶液显酸性,检验硫酸根离子应选择氯化钡溶液;乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫.
解答:
解:(1)打开K1~K4,关闭K5、K6,通入一段时间N2,目的是排出装置中的氧气,故答案为:排出装置中的空气,防止干扰;
(2)棉花中浸有NaOH溶液,吸收多余氯气、二氧化硫,防止污染空气,故答案为:NaOH溶液;
(3)A中发生二氧化锰与浓盐酸的反应,生成氯化锰、氯气、水,该反应为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(4)SO2具有还原性,酸性高锰酸钾溶液具有强的氧化性,二者混合后可以发生氧化还原反应:2MnO4-+5SO2+4H2O=2Mn2++5SO42-+4H+,使高锰酸钾褪色,故答案为:2MnO4-+5SO2+4H2O=2Mn2++5SO42-+4H+;
(5)溶液显酸性,检验硫酸根离子应选择氯化钡溶液;乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫;故答案为:乙、丙.
(2)棉花中浸有NaOH溶液,吸收多余氯气、二氧化硫,防止污染空气,故答案为:NaOH溶液;
(3)A中发生二氧化锰与浓盐酸的反应,生成氯化锰、氯气、水,该反应为:MnO2+4HCl(浓)
| ||
,故答案为:MnO2+4HCl(浓)
| ||
(4)SO2具有还原性,酸性高锰酸钾溶液具有强的氧化性,二者混合后可以发生氧化还原反应:2MnO4-+5SO2+4H2O=2Mn2++5SO42-+4H+,使高锰酸钾褪色,故答案为:2MnO4-+5SO2+4H2O=2Mn2++5SO42-+4H+;
(5)溶液显酸性,检验硫酸根离子应选择氯化钡溶液;乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫;故答案为:乙、丙.
点评:本题考查性质实验方案的设计及氧化还原反应,明确装置的作用及发生的反应是解答的关键,注意氧化性的比较是解答的难点,题目难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示.导致该现象的主要原因是液滴之下氧气含量比边缘处少.下列说法正确的是( )| A、液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| B、液滴边缘是负极区,发生的电极反应为O2+2H2O+4e-═4OH- |
| C、液滴中的Cl-由b区向a区迁移 |
| D、若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+ |
X和Y属短周期元素,X原子的次外层电子数是最外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y所形成的化合物的化学式可表示为( )
| A、XY |
| B、XY2 |
| C、XY3 |
| D、XY4 |
下列分子中含有σ键的是共价化合物是( )
| A、F2 |
| B、金刚石 |
| C、Na2O |
| D、NH3 |
室温下,现有三种酸,a盐酸、b乙酸、c硫酸的稀溶液,下列说法正确的是( )
| A、同浓度,pH由大到小:c>a>b |
| B、同浓度同体积,分别与氢氧化钠中和,所需的氢氧化钠的物质的量由大到小:c>a>b |
| C、同pH,物质的量浓度由大到小:b>a>c |
| D、同pH同体积,分别于少量且质量相同的Zn片反应,反应所需时间由长到短:b>a>c |