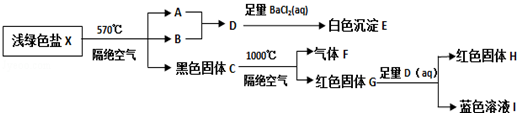
题目内容
4.下列叙述正确的是( )| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等物质的量浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 25℃时,0.1 mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 | |
| D. | PH=2的酸HA溶液与PH=12的碱BOH溶液等体积混合后,所得溶液呈酸性,证明HA为强酸 |
分析 A.加入醋酸钠,溶液中醋酸根离子浓度增大,抑制醋酸的电离;
B.25℃时,等体积等浓度的硝酸与氨水混合后为NH4NO3溶液,溶液中铵根离子水解,溶液呈酸性;
C.硫化氢为弱电解质,而硫化钠为强电解质,等浓度溶液中硫化氢溶液中离子浓度远远小于硫化钠溶液中离子浓度;
D.当HA与BOH均为弱电解质时,且电离程度相同,混合时可以显中性.
解答 解:A.稀醋酸溶液中存在平衡:CH3COOH?CH3COO-+H+,加入醋酸钠,溶液中CH3COO-离子浓度增大,抑制醋酸的电离,故A错误;
B.25℃时,等体积等浓度的硝酸与氨水混合后为NH4NO3溶液,溶液中铵根离子水解,溶液呈酸性,故溶液pH<7,故B错误;
C.硫化氢为弱电解质,部分电离,而硫化钠为强电解质,等浓度溶液中硫化氢溶液中离子浓度远远小于硫化钠溶液中离子浓度,硫化氢溶液比等浓度的硫化钠溶液的导电能力弱,故C正确;
D.PH=2的酸HA溶液与PH=12的碱BOH溶液等体积混合,当HA与BOH均为弱电解质时,且电离程度相同,混合时可以显中性,所以HA不一定是强酸,故D错误;
故选C.
点评 本题考查盐类水解、溶液导电性、弱电解质的电离平衡及其影响因素,为高频考点,侧重于学生的分析能力的考查,难度不大,注意电解质溶液中离子浓度大小的比较分析.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
14.两种气态单质按下列反应X2(g)+Y2(g)?2XY(g),X2与Y2按一定比例混合,在不同温度下经一定时间反应,混合物中X2的体积分数变化如图所示,试确定该反应是吸热反应还是放热反应放热反应.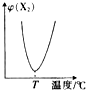

12.下列离子方程式的书写及评价均合理的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将2molC l2通入到含1mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、 I-均氧化 |
| B | Ba(HCO3)2溶液与足量的NaOH溶液反应:B a2++HCO3-+OH-=B aCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
| C | 1mol•L-1的Na[Al(OH)4]溶液和2.5mol•L-1的HCl溶液等体积互相均匀混合:2[Al(OH)4]-+5H+=A l3++Al(OH)3↓+5H2O | 正确;[Al(OH)4]-与Al(OH)3消耗的H+的物质的量之比为2:3 |
| D | 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
| A. | A | B. | B | C. | C | D. | D |
19.足量的镁与一定质量的盐酸反应,由于反应速率太快,若要减慢反应速率,但不能影响产生氢气的总质量,可以加入下列物质中的是( )
| A. | H2O | B. | NaOH | C. | K2CO3 | D. | CH3COONa |
16.根据下列反应的化学方程式,试判断有关物质的还原性强弱顺序( )
I2+SO2+2H2O=4H++SO42-+2I-
2Fe2++Cl2=2Fe3++2Cl-
2Fe3++2I-=2Fe2++I2.
I2+SO2+2H2O=4H++SO42-+2I-
2Fe2++Cl2=2Fe3++2Cl-
2Fe3++2I-=2Fe2++I2.
| A. | I->Fe2+>Cl->SO2 | B. | Cl->Fe2+>SO2>I- | C. | Fe2+>I->Cl->SO2 | D. | SO2>I->Fe2+>Cl- |
14.除去铁粉中混有的少量铝粉,可选用的试剂是( )
| A. | H2O | B. | 浓H2SO4 | C. | NaCl | D. | NaOH |