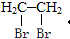题目内容
13.铜镁合金9.2g 完全溶于浓硝酸中,反应中硝酸被还原只产生10304mL (标准状况下)NO2气体.向反应后的溶液中加足量NaOH溶液,生成沉淀的质量为( )| A. | 16.51 g | B. | 23.82 g | C. | 24.84 g | D. | 17.02 g |
分析 铜和镁失去的电子的物质的量,等于硝酸被还原为二氧化氮获得的电子的物质的量,等于镁离子、铜离子他们结合的氢氧根离子的物质的量,根据氮的氧化物计算氢氧根的物质的量,沉淀为氢氧化镁、氢氧化铜,沉淀的总质量=金属质量与氢氧根的质量之和.
解答 解:10304mLNO2气体的物质的量为:$\frac{10.304L}{22.4L/mol}$=0.46mol,生成0.46mol二氧化氮需要转移电子的物质的量为:0.46mol×(5-4)=0.46mol,
则沉淀中含有氢氧根的物质的量为0.46mol,0.46mol氢氧根的质量为:0.46mol×17g/mol=7.82g,
所以向反应后的溶液中加足量NaOH溶液,生成沉淀的质量为:9.2g+7.82g=17.02g,
故选D.
点评 本题考查混合物反应的计算,题目难度中等,明确“铜和镁失去的电子的物质的量等于他们结合的氢氧根的物质的量”为解答关键,注意掌握守恒思想在化学计算中的应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L CCl4中共价键数目为4NA | |
| B. | 22.4 L O2和N2的混合气体中一定含有的原子数为2NA | |
| C. | 常温常压下,6 g NO2和40 g N2O4混合气体中的原子总数为3NA | |
| D. | 25℃时,1mol•L-1醋酸溶液中所含CH3COOH分子总数一定小于NA |
4.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | B. | 次氯酸电子式 | ||
| C. | F原子结构示意图: | D. | CH4分子的球棍模型: |
18.下列说法错误的是( )
| A. | 钢铁发生析氢腐蚀时,负极电极反应是Fe-2e-=Fe2+ | |
| B. | 根据盖斯定律,可计算某些难以直接测定的反应焓变 | |
| C. | 增大压强不能降低活化能,但能增加活化分子百分数 | |
| D. | 一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0△S>0 |
2.下列关于气体的实验室制取方法,说法正确的是( )
| A. | 可用加热试管中的NH4Cl制取NH3 | |
| B. | 可用MnO2固体和稀盐酸共热制取Cl2 | |
| C. | 可用炽热的碳和浓硫酸反应制取SO2 | |
| D. | 可用铝箔和NaOH溶液反应制取H2 |
9.下列溶液常温下能跟镁反应生成H2的是( )
| A. | NaOH | B. | NaHCO3 | C. | NH4Cl | D. | CH3COONa |
 如图为某有机物的质谱图,测得其含碳量为76.6%,含氢量为6.4%,其余为氧元素.
如图为某有机物的质谱图,测得其含碳量为76.6%,含氢量为6.4%,其余为氧元素. ;
; +3HBr;
+3HBr; +H2O.
+H2O. ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3).C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.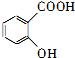 .
. (其中两种).
(其中两种). 为主要原料制备
为主要原料制备 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{△}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{△}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$