题目内容
4.下列各项中表达正确的是( )| A. | H、D、T表示同一种核素 | B. | 次氯酸电子式 | ||
| C. | F原子结构示意图: | D. | CH4分子的球棍模型: |
分析 A.具有一定质子数和中子数的原子就是一种核素;
B.次氯酸中存在1个氧氢键和1个氧氯键;
C.F的质子数和核外电子数为9;
D.甲烷为正四面体结构,其正确的球棍模型为: .
.
解答 解:A.H、D、T为氢元素的3种不同核素,它们之间互为同位素,故A错误;
B.次氯酸为共价化合物,分子中存在1个氧氢键和氧氯键,次氯酸的电子式为 ,故B错误;
,故B错误;
C.F的原子结构示意图为 ,故C错误;
,故C错误;
D. 为甲烷的比例模型,甲烷的球棍模型应该用小球和短棍表示,甲烷为正四面体结构,其正确的球棍模型为:
为甲烷的比例模型,甲烷的球棍模型应该用小球和短棍表示,甲烷为正四面体结构,其正确的球棍模型为: ,故D正确.
,故D正确.
故选D.
点评 本题考查了核素、电子式、原子结构示意图判断以及球棍模型与比例模型,题目难度中等,注意掌握常见化学用语的表示方法,明确球棍模型与比例模型的区别.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
15.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,22.4 L CCl4含有4nA个Cl原子 | |
| B. | 7.8 g Na2O2与足量水反应转移0.2nA个电子 | |
| C. | 0.1 mol•L-1NaCl溶液中含有0.1nA个Na+ | |
| D. | 常温常压下,23 gNO2、N2O4混合气体中含有nA个氧原子 |
9.用价层电子对互斥理论预测H2S和CH2O分子的立体结构,两个结论都正确的是( )
| A. | 直线形;平面三角形 | B. | V形;三角锥形 | ||
| C. | 直线形;三角锥形 | D. | V形;平面三角形 |
16.下列化合物中,既能发生消去反应,又能发生水解反应的是( )
| A. | 氯仿 | B. | 1-氯丙烷 | C. | 2-丁醇 | D. | 2-甲基-2-溴丙烷 |
13.铜镁合金9.2g 完全溶于浓硝酸中,反应中硝酸被还原只产生10304mL (标准状况下)NO2气体.向反应后的溶液中加足量NaOH溶液,生成沉淀的质量为( )
| A. | 16.51 g | B. | 23.82 g | C. | 24.84 g | D. | 17.02 g |
14.在一密闭容器中,充入2mol A发生反应mA(g)?nB(g)+C(s),达平衡后,下列说法正确的是( )
| A. | 加入一定量C,平衡逆向移动 | |
| B. | 保持温度不变,容器容积压缩到原来的一半,物质B的浓度变为原来的1.8倍,则平衡正向移动 | |
| C. | 恒温恒压,再充入1mol氦气(不参与反应),A的转化率增大,则m<n | |
| D. | 恒温恒压,再加入2mol的A,气体的平均相对分子质量变为原来的2倍 |
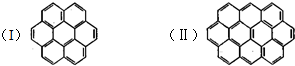 有两个或两个以上的苯环以共有环边的方式相互稠合的多环芳香烃称为稠环芳香烃.下图中椭圆烯也属于稠环芳香烃.据此回答:
有两个或两个以上的苯环以共有环边的方式相互稠合的多环芳香烃称为稠环芳香烃.下图中椭圆烯也属于稠环芳香烃.据此回答: ;
;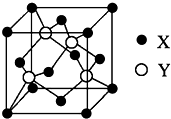 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题: