题目内容
9.下列溶液常温下能跟镁反应生成H2的是( )| A. | NaOH | B. | NaHCO3 | C. | NH4Cl | D. | CH3COONa |
分析 金属镁的金属强较强,可以和酸或是水解显酸性的盐溶液反应生成氢气.
解答 解:A、氢氧化钠和金属镁不反应,故A错误;
B、NaHCO3溶液水解呈碱性,不与金属镁反应,故B错误;
C、氯化铵中的铵根离子水解显酸性,可以和金属镁反应产生氢气,故C正确;
D、CH3COONa中的醋酸根离子水解显碱性,不能和金属镁反应,故D错误.
故选C.
点评 本题考查学生金属镁的化学性质,由于盐中某些离子的水解导致盐溶液有的不再显中性是解此题的关键,难度不大.

练习册系列答案
相关题目
13.铜镁合金9.2g 完全溶于浓硝酸中,反应中硝酸被还原只产生10304mL (标准状况下)NO2气体.向反应后的溶液中加足量NaOH溶液,生成沉淀的质量为( )
| A. | 16.51 g | B. | 23.82 g | C. | 24.84 g | D. | 17.02 g |
14.在一密闭容器中,充入2mol A发生反应mA(g)?nB(g)+C(s),达平衡后,下列说法正确的是( )
| A. | 加入一定量C,平衡逆向移动 | |
| B. | 保持温度不变,容器容积压缩到原来的一半,物质B的浓度变为原来的1.8倍,则平衡正向移动 | |
| C. | 恒温恒压,再充入1mol氦气(不参与反应),A的转化率增大,则m<n | |
| D. | 恒温恒压,再加入2mol的A,气体的平均相对分子质量变为原来的2倍 |
14.根据下列三个反应的化学方程式,判断有关物质的还原性的强弱顺序( )
①I2+SO2+2H2O═H2SO4+2HI
②2FeCl2+Cl2═2FeCl3
③2FeCl3+2HI═2FeCl2+I2+2HCl.
①I2+SO2+2H2O═H2SO4+2HI
②2FeCl2+Cl2═2FeCl3
③2FeCl3+2HI═2FeCl2+I2+2HCl.
| A. | I->Fe2+>Cl->SO2 | B. | Cl->Fe2+>SO2>I- | ||
| C. | Fe2+>I->Cl->Cl->SO2 | D. | SO2>I->Fe2+>Cl- |
1.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.下列反应可制取K2FeO4:
2Fe(OH)3+3Cl2+10KOH $\frac{\underline{\;0~30℃\;}}{\;}$2K2FeO4+6KCl+8H2O
对于该反应,下列说法正确的是( )
2Fe(OH)3+3Cl2+10KOH $\frac{\underline{\;0~30℃\;}}{\;}$2K2FeO4+6KCl+8H2O
对于该反应,下列说法正确的是( )
| A. | 水是还原产物 | B. | Fe(OH)3发生还原反应 | ||
| C. | Cl2是氧化剂 | D. | 每生成1mol K2FeO4转移2mol电子 |
18.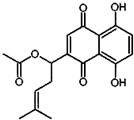 乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法正确的是( )
乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法正确的是( )
 乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法正确的是( )
乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法正确的是( )| A. | 该分子中含有1个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol 乙酰紫草素最多可与2molBr2反应 | |
| D. | 1mol乙酰紫草素最多可与2molNaOH反应 |
19.摩尔盐[(NH4)2Fe(SO4)2•6H2O]在定量分析中常作为基准物质,用来标定重铬酸钾、高锰酸钾等溶液的浓度,在0.1mol•L-1 的该盐的溶液中,下列有关比较错误的是( )
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(NH3•H2O)+c(NH4+)=0.2mol•L-1 | ||
| C. | 2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+) | D. | c(H+)=c(OH-)+c(NH3•H2O) |