题目内容
12.设NA为阿伏加罗常数的值,下列说法正确的是( )| A. | 标准状况下,22.4LCH2Cl2中含有C-Cl键数目为0.2NA | |
| B. | 常温常压下,3.0g尿素与乙酸的混合物,含氢原子总数为0.2NA | |
| C. | 常温常压下,10g92%酒精水溶液含氧原子总数为0.2NA | |
| D. | 常温常压下,0.1molNa2O2与水完全反应转移电子数为0.2NA |
分析 A、标况下二氯甲烷为液态;
B、尿素和乙酸的含氢量相同;
C、水溶液中水中也含氧原子;
D、过氧化钠中氧元素的化合价为-1价,1mol Na2O2与水完全反应生成0.5mol氧气,转移了1mol电子;
解答 解:A.标准状况下,CH2Cl2是液体,22.4L不是1mol,故A错误;
B、尿素和乙酸的含氢量相同,3.0g尿素与乙酸的混合物,含氢原子总数为0.2NA,故B正确;
C、溶剂水中含有氧原子,10g92%酒精水溶液含氧原子总数大于0.2NA,故C错误;
D、过氧化钠与水反应时,氧元素的价态由-1价变为0价,且为歧化反应,0.1molNa2O2与水完全反应转移电子数为0.1NA,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
2.有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
| A. | 盐酸 | B. | 烧碱溶液 | C. | 液氨水 | D. | KSCN溶液 |
3.25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
| A. | c(NH4+)=c(SO42-) | B. | c(NH4+)=2c(SO42-) | ||
| C. | 2c(NH4+)=c(SO42-) | D. | c(OH-)+c(SO42-)=c(H+)+c(NH4+) |
20.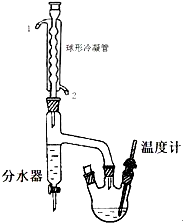 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
2CH3CH2CH2CH2OH $\stackrel{H_{2}SO_{4}}{→}$ CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
反应物和产物的相关数据列表如下:
实验步骤:
在一定容积的三口烧瓶中,加入10.9g(相当13.5mL)正丁醇、2.5mL浓硫酸和几粒沸石,摇匀后,一口装上温度计,温度计插入液面以下,另一口装上分水器,分水器的上端接球形冷凝管,先在分水器内放置1.7mL水,另一口用塞子塞紧.然后将三口瓶放在石棉网上小火加热至微沸,进行分水.反应中产生的水经球形冷凝管后,收集在分水器的下层,上层有机层积至分水器支管时,即可返回烧瓶.大约经1.5h后,三口瓶中反应液温度可达134一136℃,当下层水至分水器的支管口处停止反应.
将反应液冷却到室温后倒入盛有25mL水的分液漏斗中,经过分离、洗涤后再分离提纯可得正丁醚3.4g.回答下列问题:
(1)该实验时球形冷凝管的进水口为2(填1或2);
(2)本实验中容易产生烃类化合物的化学反应方程式为:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$C2H5CH=CH2+H2O.
(3)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,振荡静置,得到有机层的操作方法是将分液漏斗颈上的玻璃塞打开,在将分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁流下,关闭分液漏斗,将上层有机物从分液漏斗上口倒出.
(4)有机层粗产物依次用12mL水、8mL 5%氢氧化钠溶液、8mL水和8mL饱和氯化钙溶液洗涤.用氢氧化钠溶液洗涤的目的是除去产品中的硫酸.
(5)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是cba(填字母).
a.蒸馏 b.过滤 c.加入无水CaCl2
(6)本实验所得到的正丁醚产率为35.34%.
 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:2CH3CH2CH2CH2OH $\stackrel{H_{2}SO_{4}}{→}$ CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
反应物和产物的相关数据列表如下:
| 化合物名称 | 密度(g/mL) | 熔点(℃) | 沸点(℃) | 水中溶解性 |
| 正丁醇 | 0.810 | -89.8 | 118.0 | 微溶 |
| 正丁醚 | 0.7689 | -95.3 | 142 | 不溶于水 |
| 备注:正丁醚微溶于饱和氯化钙溶液. | ||||
在一定容积的三口烧瓶中,加入10.9g(相当13.5mL)正丁醇、2.5mL浓硫酸和几粒沸石,摇匀后,一口装上温度计,温度计插入液面以下,另一口装上分水器,分水器的上端接球形冷凝管,先在分水器内放置1.7mL水,另一口用塞子塞紧.然后将三口瓶放在石棉网上小火加热至微沸,进行分水.反应中产生的水经球形冷凝管后,收集在分水器的下层,上层有机层积至分水器支管时,即可返回烧瓶.大约经1.5h后,三口瓶中反应液温度可达134一136℃,当下层水至分水器的支管口处停止反应.
将反应液冷却到室温后倒入盛有25mL水的分液漏斗中,经过分离、洗涤后再分离提纯可得正丁醚3.4g.回答下列问题:
(1)该实验时球形冷凝管的进水口为2(填1或2);
(2)本实验中容易产生烃类化合物的化学反应方程式为:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$C2H5CH=CH2+H2O.
(3)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,振荡静置,得到有机层的操作方法是将分液漏斗颈上的玻璃塞打开,在将分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁流下,关闭分液漏斗,将上层有机物从分液漏斗上口倒出.
(4)有机层粗产物依次用12mL水、8mL 5%氢氧化钠溶液、8mL水和8mL饱和氯化钙溶液洗涤.用氢氧化钠溶液洗涤的目的是除去产品中的硫酸.
(5)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是cba(填字母).
a.蒸馏 b.过滤 c.加入无水CaCl2
(6)本实验所得到的正丁醚产率为35.34%.
17.化学与生产、生活、社会密切相关,下列说法正确的是( )
| A. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮的氧化物无关 | |
| B. | 乙醇溶液、臭氧、双氧水、高锰酸钾溶液均可用于消毒杀菌,且原理不同 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 纯碱是焙制糕点所用的发酵粉的主要成分之一,也可用纯碱除去物品表面的油污 |
4.下列说法不正确的是( )
| A. | “煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气 | |
| B. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物,有固定的熔点、沸点 | |
| C. | 2014年诺贝尔化学奖授予美国科学家埃里克•贝齐格、威廉•莫纳和德国科学家斯特凡•黑尔,以表彰他们为发展超分辨率荧光显微镜所作的贡献,他们的研究允许了人类观察病毒以至细胞内的蛋白质 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油,可以实现厨余废物合理利用 |
1.化学与环境、科学、技术密切相关.下列有关说法中正确的是( )
| A. | 可使用填埋法处理未经分类的生活垃圾 | |
| B. | 光化学烟雾的形成与汽车尾气中的氮氧化物有关 | |
| C. | 光导纤维都是有机高分子化合物 | |
| D. | “鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
2.下列说法正确的是( )
| A. | 萃取溴水中的溴,将四氯化碳和溴水混合后,振荡并打开分液漏斗瓶塞,使漏斗内气体放出 | |
| B. | 在蔗糖中加入浓硫酸时,蔗糖变黑,证明浓硫酸具有脱水性 | |
| C. | 向Ba(NO3)2溶液中通入SO2气体,产生白色沉淀,可推测SO2与可溶性钡盐均能反应产生白色沉淀 | |
| D. | 若要检验铜和浓硫酸反应后产物硫酸铜,可向反应后的试管中加入少量水,观察溶液是否变蓝,若变蓝则证明有硫酸铜生成 |
