题目内容
11.Ⅰ某火力发电厂以煤为燃料,排出的废气中含有CO2、SO2、水蒸气.为检验该废气中的成分,用如图所示的装置进行实验: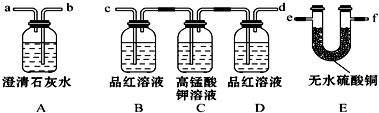
(1)仪器连接的顺序为(填导管接口字母)e→f→c→d→b→a;
(2)根据B中品红褪色现象证明有SO2,根据D中品红不褪色,A中有白色沉淀现象证明有CO2;
(3)装置B的作用是检验SO2,装置D的作用是检验SO2是否除尽.
Ⅱ为探究SO2的漂白是SO2直接作用于有色物质,还是SO2与水反应的产物的作用,设计如图2装置进行实验:
(图中所用硫酸的质量分数为70%)
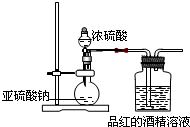
(4)亚硫酸钠与浓硫酸反应的化学方程式:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H20;
(5)为探究干燥的SO2 能不能使品红褪色,请指出设计的实验装置图中两个明显的不足:①二氧化硫没有干燥(或缺少二氧化硫的干燥装置),
②没有尾气吸收装置;
(6)按照修改后的装置,实验中控制SO2以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是SO2直接导致.所以,SO2 通过品红水溶液后,引起品红褪色的微粒可能是H2SO3、HSO3-、SO3 2-.
分析 Ⅰ、根据二氧化碳能使澄清石灰水变浑浊,使用装置A中盛放的澄清石灰水检验二氧化碳;根据SO2既能使品红溶液褪色还能被高锰酸钾溶液氧化而除去,使用装置B中品红溶液检验二氧化硫,利用装置C中高锰酸钾溶液吸收二氧化硫,使用装置D中品红溶液检验二氧化硫是否完全吸收;根据无水硫酸铜与水由白变蓝,使用装置E中盛有的白色无水硫酸铜检验水,由于二氧化硫也能使澄清石灰水变混浊,且A、B、C、D中的水蒸气可能随气流进入E中,利用检验过程中互不干扰的原则,合理连接检验装置;
Ⅱ(4)亚硫酸钠与浓硫酸反应生成硫酸钠、二氧化硫和水,反应的化学方程式:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H20;
(5)根据实验目的及二氧化硫的性质分析,制取干燥的气体且二氧化硫有毒,应有尾气处理装置;
(6)根据二氧化硫和水反应的方程式判断溶液中存在的微粒,注意二氧化硫和水的反应是可逆反应.
解答 解:(1)由于A、B、C、D中的水蒸气可能随气流进入E中会影响对废气中水检验,因此应把装置E放在整套装置的最前端,首先检验废气中是否含有水;由于二氧化硫也能使澄清石灰水变混浊,因此在使用澄清石灰水检验二氧化碳前应把废气中可能含有二氧化硫检验并全部除去;这样分析下来,最后利用澄清石灰水检验废气中的二氧化碳即可完成整个检验任务;在连接装置时,还需要注意进气管与出气管的选择,进气管一定要伸入溶液中;因此连接顺序为e→f→c→d→b→a,故答案为:e→f→c→d→b→a;
(2)废气通入装置B时,含有的二氧化硫气体能使品红溶液褪色,因此观察到此处品红溶液褪色时即可说明废气中含有二氧化硫;装置D的品红溶液如果不褪色,说明废气中的二氧化硫已完全被装置C中高锰酸钾溶液吸收,则不会影响后面对二氧化碳的检验;此时装置A中澄清石灰水变浑浊,即说明废气中含有二氧化碳,故答案为:B中品红褪色;D中品红不褪色,A中有白色沉淀;
(3)根据对二氧化硫的检验与吸收:使用装置B中品红溶液检验二氧化硫,利用装置C中高锰酸钾溶液吸收二氧化硫,使用装置D中品红溶液检验二氧化硫是否完全吸收,故答案为:检验SO2;检验SO2是否除尽;
Ⅱ(4)亚硫酸钠与浓硫酸反应生成硫酸钠、二氧化硫和水,反应的化学方程式:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H20,故答案为:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H20;
(5)该实验是探究干燥的SO2能不能使品红褪色,所以二氧化硫通入品红溶液前要进行干燥;二氧化硫有毒,所以多余气体不能直接排空,故要有尾气处理装置.
故答案为:①二氧化硫没有干燥(或缺少二氧化硫的干燥装置);②没有尾气吸收装置;
(6)二氧化硫和水反应生成亚硫酸,亚硫酸是二元弱酸,所以能发生两步电离,第一步生成氢离子和亚硫酸氢根离子,亚硫酸氢根离子电离生成亚硫酸根离子和氢离子,SO2+H2O?H2SO3,H2SO3?H++HSO3-,HSO3-?H++SO32-,这些反应都是可逆反应,所以存在的含有硫元素的微粒有(除二氧化硫外)H2SO3、HSO3-、SO3 2-.
故答案为:H2SO3、HSO3-、SO3 2-.
点评 本题考查了二氧化硫漂白性的探究实验,难度较大,分析图中各个装置在检验的过程中所发挥的作用,这是解答此类问题首先应明确的关键问题.

 阅读快车系列答案
阅读快车系列答案MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
| 20℃ | K2CO3 | KHCO3 | K2MnO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
实验流程如下:
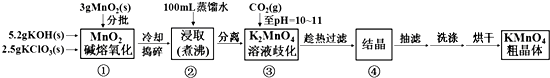
请回答:
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
③下列监控K2MnO4歧化完全的方法或操作可行的是BC.
A.通过观察溶液颜色变化,若溶液颜色由绿色完全变成紫红色,表明反应已歧化完全
B.取上层清液少许于试管中,继续通入CO2,若无沉淀产生,表明反应已歧化完全
C.用玻璃棒蘸取溶液点在滤纸上,若滤纸上只有紫红色痕迹,无绿色痕迹,表明反应已歧化完全
D.用pH试纸测定溶液的pH值,对照标准比色卡,若pH为10~11,表明反应已歧化完全
(3)步骤④的操作是把滤液移至蒸发皿内,用小火加热,当浓缩至液面出现晶膜(填实验现象)时,停止加热,冷却,即有KMnO4晶体析出.
(4)烘干时,温度控制在80℃为宜,理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(5)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①实验时先将草酸晶体(H2C2O4•2H2O)配成标准溶液,实验室常用的容量瓶的规格有100mL、250mL等多种,现配制90mL 1.5mol•L-1的草酸溶液,需要称取草酸晶体的质量为18.9g.[已知Mr(H2C2O4•2H2O)=126]
②量取KMnO4溶液应选用酸式(填“酸式”或“碱式”)滴定管,若该滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小(填“偏大”、“偏小”或“不变”).
| A. | 盐酸 | B. | 烧碱溶液 | C. | 液氨水 | D. | KSCN溶液 |

| A. | C72H48 | B. | C72H50 | C. | C72H52 | D. | C72H54 |
| A. | 氨气可以用浓硫酸干燥也可用碱石灰干燥 | |
| B. | 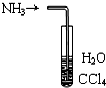 用如图装置吸收NH3可防止倒吸 用如图装置吸收NH3可防止倒吸 | |
| C. | 氨水能导电,所以NH3是电解质 | |
| D. | 氨气可以使湿润的蓝色石蕊试纸变红,依此可检验氨气 |
| A. | Na+、Al3+、SO42-、HCO3- | B. | Na+、Ba2+、Cl-、SO42- | ||
| C. | Fe3+、Mg2+、SO42-、NO3- | D. | Cu2+、K+、NO3-、I- |
| A. | c(NH4+)=c(SO42-) | B. | c(NH4+)=2c(SO42-) | ||
| C. | 2c(NH4+)=c(SO42-) | D. | c(OH-)+c(SO42-)=c(H+)+c(NH4+) |
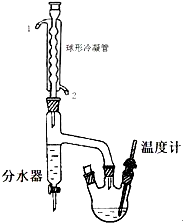 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:2CH3CH2CH2CH2OH $\stackrel{H_{2}SO_{4}}{→}$ CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
反应物和产物的相关数据列表如下:
| 化合物名称 | 密度(g/mL) | 熔点(℃) | 沸点(℃) | 水中溶解性 |
| 正丁醇 | 0.810 | -89.8 | 118.0 | 微溶 |
| 正丁醚 | 0.7689 | -95.3 | 142 | 不溶于水 |
| 备注:正丁醚微溶于饱和氯化钙溶液. | ||||
在一定容积的三口烧瓶中,加入10.9g(相当13.5mL)正丁醇、2.5mL浓硫酸和几粒沸石,摇匀后,一口装上温度计,温度计插入液面以下,另一口装上分水器,分水器的上端接球形冷凝管,先在分水器内放置1.7mL水,另一口用塞子塞紧.然后将三口瓶放在石棉网上小火加热至微沸,进行分水.反应中产生的水经球形冷凝管后,收集在分水器的下层,上层有机层积至分水器支管时,即可返回烧瓶.大约经1.5h后,三口瓶中反应液温度可达134一136℃,当下层水至分水器的支管口处停止反应.
将反应液冷却到室温后倒入盛有25mL水的分液漏斗中,经过分离、洗涤后再分离提纯可得正丁醚3.4g.回答下列问题:
(1)该实验时球形冷凝管的进水口为2(填1或2);
(2)本实验中容易产生烃类化合物的化学反应方程式为:CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$C2H5CH=CH2+H2O.
(3)反应液冷却到室温后倒入盛有25mL水的分液漏斗中,振荡静置,得到有机层的操作方法是将分液漏斗颈上的玻璃塞打开,在将分液漏斗下面活塞拧开,使下层液体慢慢沿烧杯壁流下,关闭分液漏斗,将上层有机物从分液漏斗上口倒出.
(4)有机层粗产物依次用12mL水、8mL 5%氢氧化钠溶液、8mL水和8mL饱和氯化钙溶液洗涤.用氢氧化钠溶液洗涤的目的是除去产品中的硫酸.
(5)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是cba(填字母).
a.蒸馏 b.过滤 c.加入无水CaCl2
(6)本实验所得到的正丁醚产率为35.34%.
| A. | 可使用填埋法处理未经分类的生活垃圾 | |
| B. | 光化学烟雾的形成与汽车尾气中的氮氧化物有关 | |
| C. | 光导纤维都是有机高分子化合物 | |
| D. | “鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |