题目内容
8.下列关于卤素(用X表示)的叙述中正确的是( )| A. | 卤素单质与水反应的通式为X2+H2O═HX+HXO | |
| B. | HX都极易溶于水,它们的稳定性随核电荷数的增加而增强 | |
| C. | 卤素单质的颜色随相对分子质量的增大而加深 | |
| D. | X2的氧化性随核电荷数的增加而增强 |
分析 A.氟气和水反应生成HF和氧气;
B.卤族元素的非金属性越强,其氢化物越稳定;
C.卤族元素单质随着原子序数的增大而逐渐加深;
D.元素的非金属性越强,其单质的氧化性越强;
解答 解:A.氟气和水反应生成HF和氧气,氯气、溴、碘单质与水反应均可用X2+H2O═HXO+HX表示,故A错误;
B.卤族元素的非金属性越强,其氢化物越稳定,卤族元素氢化物都易溶于水,但它们的热稳定性随核电荷数增大而减弱,故B错误;
C.卤族元素单质随着原子序数的增大而逐渐加深,所以卤素单质从F2→I2颜色逐渐加深,故C正确;
D.元素的非金属性越强,其单质的氧化性越强,非金属性强弱F>Cl>Br>I,所以卤素单质的氧化性随核电荷数的增加而减弱,故D错误;
故选C.
点评 本题考查了卤族元素性质的递变规律,知道其规律中的异常现象即可解答,知道氟气和水的反应产物,卤族元素氢化物中HF为弱酸,盐酸、氢溴酸、氢碘酸都是强酸,为易错点.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
18.已知(NH4)2SO4+2NaOH=Na2SO4+2NH3•H2O,现将400mLMgCl2、K2SO4、(NH4)2SO4的混合溶液分成两等份,取一份加入含amolBaCl2的溶液,刚好使SO42-沉淀完全,继续加入含bmolAgNO3的溶液,刚好使Cl-沉淀完全,另取一份加入含cmolNaOH的溶液,恰好完全反应,则该溶液中K+浓度为( )
| A. | 5(b+2a-c) | B. | $\frac{5(2b-c)}{3}$ | C. | $\frac{5(2b-a+c)}{3}$ | D. | 5(b-c) |
16.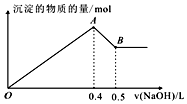 现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
 现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )| A. | 1:3 | B. | 3:1 | C. | 2:3 | D. | 6:1 |
3.将Na、Mg、Al各0.4mol分别放入100mL、2mol/L的盐酸中,同温同压下产生的气体的体积比是( )
| A. | 1:1:1 | B. | 2:1:1 | C. | 3:1:1 | D. | 1:2:3 |
20.下列醇类既能发生催化氧化反应又能发生消去反应的是( )
| A. | 2-丙醇 | B. | 3-乙基-3-戊醇 | ||
| C. | 2,2-二甲基-1-戊醇 | D. |  |
17. 短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
 短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )| A. | Be、Na、Al | B. | C、Al、P | C. | O、P、Cl | D. | B、Mg、S |
6.在实验室中进行过滤和蒸发的实验操作,都必须用到的仪器是( )
| A. | 烧杯 | B. | 铁架台(带铁圈) | C. | 漏斗 | D. | 药匙 |