题目内容
(1)分别取Wg钠、镁、铝与足量盐酸反应,在相同条件下产生氢气的体积比是
(2)分别取0.1mol钠、镁、铝与足量盐酸反应,在相同条件下产生氢气的体积比是
(3)若产生相同物质的量的氢气,所需钠、镁、铝的物质的量之比为
(4)把0.5mol钠投入到m1g水(过量)中得到a溶液,把0.5mol镁投入到m2g盐酸(过量)中得到b溶液,若m1=m2,则a、b质量大小关系是 .
(2)分别取0.1mol钠、镁、铝与足量盐酸反应,在相同条件下产生氢气的体积比是
(3)若产生相同物质的量的氢气,所需钠、镁、铝的物质的量之比为
(4)把0.5mol钠投入到m1g水(过量)中得到a溶液,把0.5mol镁投入到m2g盐酸(过量)中得到b溶液,若m1=m2,则a、b质量大小关系是
考点:化学方程式的有关计算
专题:计算题
分析:(1)(2)(3)发生反应:2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,根据方程式计算解答;
(4)反应后的溶液质量增重=金属质量-生成氢气的质量,计算溶液质量增重进行判断.
(4)反应后的溶液质量增重=金属质量-生成氢气的质量,计算溶液质量增重进行判断.
解答:
解:(1)Wg钠、镁、铝与足量盐酸反应,则:
2Na+2HCl=2NaCl+H2↑、
46g 1mol
Wg x
故x=
=
mol
Mg+HCl=MgCl2+H2↑
24g 1mol
Wg y
故y=
=
mol
2Al+6HCl=AlCl3+3H2↑,
54g 3mol
Wg z
故Z=
=
mol
故Wg钠、镁、铝与足量盐酸反应,相同条件下产生氢气的体积比=
mol:
mol:
mol=
:
:
,
故答案为:
:
:
;
(2)分别取0.1mol钠、镁、铝与足量盐酸反应,则:
2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
0.1mol 0.05mol 0.1mol 0.1mol 0.1mol 0.15mol
故在相同条件下产生氢气的体积比=0.05mol:0.1mol:0.15mol=1:2:3,
故答案为:1:2:3;
(3)产生相同物质的量的氢气,设氢气为3mol,则:
2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
6mol 3mol 3mol 3mol 2mol 3mol
故所需钠、镁、铝的物质的量之比=6mol:3mol:2mol=6:3:2,
故答案为:6:3:2;
(4)把0.5mol钠投入到m1g水(过量)中,则:
2Na+2H2O=2NaOH+H2↑
0.5mol 0.25mol
故溶液质量增重=0.5mol×23g/mol-0.25mol×2g/mol=11g,
把0.5mol镁投入到m2g盐酸(过量)中,则:
Mg+HCl=MgCl2+H2↑
0.5mol 0.5mol
故溶液质量增重=0.5mol×24g/mol-0.5mol×2g/mol=11g,
由于m1=m2,则所得溶液质量相等,即a=b,
故答案为:a=b.
2Na+2HCl=2NaCl+H2↑、
46g 1mol
Wg x
故x=
| Wg×1mol |
| 46g |
| W |
| 46 |
Mg+HCl=MgCl2+H2↑
24g 1mol
Wg y
故y=
| Wg×1mol |
| 24g |
| W |
| 24 |
2Al+6HCl=AlCl3+3H2↑,
54g 3mol
Wg z
故Z=
| Wg×3mol |
| 54g |
| W |
| 18 |
故Wg钠、镁、铝与足量盐酸反应,相同条件下产生氢气的体积比=
| W |
| 46 |
| W |
| 24 |
| W |
| 18 |
| 1 |
| 23 |
| 1 |
| 12 |
| 1 |
| 9 |
故答案为:
| 1 |
| 23 |
| 1 |
| 12 |
| 1 |
| 9 |
(2)分别取0.1mol钠、镁、铝与足量盐酸反应,则:
2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
0.1mol 0.05mol 0.1mol 0.1mol 0.1mol 0.15mol
故在相同条件下产生氢气的体积比=0.05mol:0.1mol:0.15mol=1:2:3,
故答案为:1:2:3;
(3)产生相同物质的量的氢气,设氢气为3mol,则:
2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
6mol 3mol 3mol 3mol 2mol 3mol
故所需钠、镁、铝的物质的量之比=6mol:3mol:2mol=6:3:2,
故答案为:6:3:2;
(4)把0.5mol钠投入到m1g水(过量)中,则:
2Na+2H2O=2NaOH+H2↑
0.5mol 0.25mol
故溶液质量增重=0.5mol×23g/mol-0.25mol×2g/mol=11g,
把0.5mol镁投入到m2g盐酸(过量)中,则:
Mg+HCl=MgCl2+H2↑
0.5mol 0.5mol
故溶液质量增重=0.5mol×24g/mol-0.5mol×2g/mol=11g,
由于m1=m2,则所得溶液质量相等,即a=b,
故答案为:a=b.
点评:本题考查根据方程式进行的计算,比较基础,利用电子转移守恒进行更为简单,(4)中注意根据溶液质量增重进行解答.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
 控制适宜条件,将反应Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s)△H<0,设计成如图所示的原电池,一段时间后,灵敏电流计读数为零.则下列判断不正确的是( )
控制适宜条件,将反应Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s)△H<0,设计成如图所示的原电池,一段时间后,灵敏电流计读数为零.则下列判断不正确的是( )| A、此时化学反应达到平衡状态 |
| B、若此时将Sn电极换成质量较大的Sn 电极后,电流计指针偏转,c(Pb2+)将减小 |
| C、若此时向左池加入少量的Sn(NO3)2固体,电流计指针偏转,Sn电极为正极 |
| D、若此时升高温度,c(Sn2+)将减小,Pb电极为负极 |
下列说法不正确的是( )
| A、室温下,pH=2的酸溶液与pH=12的强碱溶液等体积混合,所得溶液pH≤7 |
| B、某溶液中加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变混浊,原溶液中一定含有大量CO32-或SO32- |
| C、某试液中加入盐酸酸化的氯化钡溶液,有白色沉淀,该溶液中一定含有SO42- |
| D、0.1mol/L弱酸HA溶液与 0.05mol/LNaOH溶液等体积混合后,所得溶液微粒浓度是2c(H+)+c(HA)=c(A-)+2c(OH-) |
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性.下列说法正确的是( )
| A、五种元素中原子半径最大的是E,最小的是A |
| B、A和B、D、E均能形成共价型化合物中,稳定性最差的是A、D形成的化合物 |
| C、E最高价氧化物对应水化物化学式为H2EO4 |
| D、C的单质在空气中燃烧产物的化学式为C2O |
相同温度时,有关①100mL 0.1mol/L NaHCO3②100mL 0.1mol/L Na2CO3两种溶液的叙述不正确的是( )
| A、①溶液中:c(CO32-)<c(H2CO3) |
| B、溶液的pH:②>① |
| C、溶液中的阴离子种类:②>① |
| D、②溶液中:c(HCO3-)>c(H2CO3) |

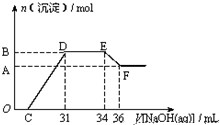 某同学取一定量Fe与Al的混合物与一定量极稀的硝酸充分反应,已知硝酸的还原产物仅有一种,在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示,试分析硝酸被还原后生成的产物为( )
某同学取一定量Fe与Al的混合物与一定量极稀的硝酸充分反应,已知硝酸的还原产物仅有一种,在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示,试分析硝酸被还原后生成的产物为( )