题目内容
如下图装置所示,是用氢氧燃料电池B进行的某电解实验:
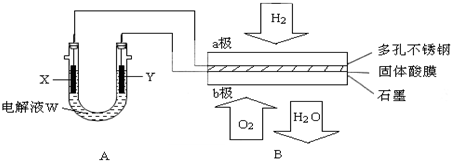
(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:Li2NH+H2=LiNH2+LiH,则下列说法中正确的是 .
A.Li2NH中N的化合价是-1
B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等
D.此法储氢和钢瓶储氢的原理相同
(2)在电池B工作时:
①若用固体Ca(HSO4)2为电解质传递H+,则电子由 极流出,H+向 极移动. (填“a”或“b”)
②b极上的电极反应式为:
③外电路中,每转移0.1mol电子,在a极消耗 L的H2(标准状况下).
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时:
①电解池中X极上的电极反应式是 .在X极这边观察到的现象是 .
②检验Y电极上反应产物的方法是 .
③若A中其它均不改变,只将电极Y换成铁棒,可实现的实验目的是 .

(1)若电池B使用了亚氨基锂(Li2NH)固体作为储氢材料,其储氢原理是:Li2NH+H2=LiNH2+LiH,则下列说法中正确的是
A.Li2NH中N的化合价是-1
B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等
D.此法储氢和钢瓶储氢的原理相同
(2)在电池B工作时:
①若用固体Ca(HSO4)2为电解质传递H+,则电子由
②b极上的电极反应式为:
③外电路中,每转移0.1mol电子,在a极消耗
(3)若A中X、Y都是惰性电极,电解液W是滴有酚酞的饱和NaCl溶液,则B工作时:
①电解池中X极上的电极反应式是
②检验Y电极上反应产物的方法是
③若A中其它均不改变,只将电极Y换成铁棒,可实现的实验目的是
考点:电解原理
专题:电化学专题
分析:(1)A.根据Li和H的化合价判断;
B.根据反应中H元素的化合价的变化分析;
C.根据在周期表中的位置判断;
D.此法储氢和钢瓶储氢的原理不同;
(2)①电子从负极流出;阳离子向正极移动;
②b电极上为氧气得电子生成水;
③根据负极上氢气与电子的关系求算;
(3)由图可知a为负极,则X为阴极;b为正极,则Y为阳极;
①X电极上是氢离子得电子生成氢气;X电极附近同时生成氢氧化钠;
②Y电极上反应产物为氯气,根据氯气具有氧化性来检验;
③将电极Y换成铁棒,则Fe电极会失电子生成Fe2+.
B.根据反应中H元素的化合价的变化分析;
C.根据在周期表中的位置判断;
D.此法储氢和钢瓶储氢的原理不同;
(2)①电子从负极流出;阳离子向正极移动;
②b电极上为氧气得电子生成水;
③根据负极上氢气与电子的关系求算;
(3)由图可知a为负极,则X为阴极;b为正极,则Y为阳极;
①X电极上是氢离子得电子生成氢气;X电极附近同时生成氢氧化钠;
②Y电极上反应产物为氯气,根据氯气具有氧化性来检验;
③将电极Y换成铁棒,则Fe电极会失电子生成Fe2+.
解答:
解:(1)A.Li2NH中Li为+1价,H为+1价,所以N的化合价是-3价,故A错误;
B.已知Li2NH+H2=LiNH2+LiH,从H2到LiNH2和LiH,氢元素部分升高为+1,部分降低为-1,所以H2既是氧化剂又是还原剂,故B正确;
C.H和Li属于同一主族,离子半径从上到下,依次减小,所以H+的离子半径小于Li+的离子半径,故C错误;
D.Li2NH+H2=LiNH2+LiH储氢为化学方法,钢瓶储氢为物理方法,它们的原理不同,故D错误;
故答案为:B;
(2)①该燃料电池中a为负极,b为正极,电子从负极流出,即从a极流出;阳离子向正极移动,所以H+向b极移动,故答案为:a,b;
②b电极上为氧气得电子生成水,其电极方程式为:O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;
③已知负极上氢气失去电子生成氢离子H2-2e=2H+,每转移0.1mol电子,在a极消耗氢气为0.05mol,所以氢气的体积为0.05mol×22.4L/mol=1.12L,
故答案为:1.12;
(3)由图可知a为负极,则X为阴极;b为正极,则Y为阳极;
①X电极上是氢离子得电子生成氢气,其电极反应式为:2H++2e-=H2↑;X电极附近同时生成氢氧化钠,所以溶液变红,故答案为:2H++2e-=H2↑;溶液变红;
②Y电极上反应产物为氯气,检验氯气的方法为:用润湿的KI淀粉试纸接近Y极气体产物,变蓝,证明产生Cl2气,
故答案为:用润湿的KI淀粉试纸接近Y极气体产物,变蓝,证明产生Cl2气;
③将电极Y换成铁棒,则Fe电极会失电子生成Fe2+,在阴极仍然为电解水,生成氢气和氢氧化钠,Fe2+与氢氧化钠反应生成氢氧化亚铁,所以可实现的实验目的是
制Fe(OH)2,
故答案为:制Fe(OH)2.
B.已知Li2NH+H2=LiNH2+LiH,从H2到LiNH2和LiH,氢元素部分升高为+1,部分降低为-1,所以H2既是氧化剂又是还原剂,故B正确;
C.H和Li属于同一主族,离子半径从上到下,依次减小,所以H+的离子半径小于Li+的离子半径,故C错误;
D.Li2NH+H2=LiNH2+LiH储氢为化学方法,钢瓶储氢为物理方法,它们的原理不同,故D错误;
故答案为:B;
(2)①该燃料电池中a为负极,b为正极,电子从负极流出,即从a极流出;阳离子向正极移动,所以H+向b极移动,故答案为:a,b;
②b电极上为氧气得电子生成水,其电极方程式为:O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;
③已知负极上氢气失去电子生成氢离子H2-2e=2H+,每转移0.1mol电子,在a极消耗氢气为0.05mol,所以氢气的体积为0.05mol×22.4L/mol=1.12L,
故答案为:1.12;
(3)由图可知a为负极,则X为阴极;b为正极,则Y为阳极;
①X电极上是氢离子得电子生成氢气,其电极反应式为:2H++2e-=H2↑;X电极附近同时生成氢氧化钠,所以溶液变红,故答案为:2H++2e-=H2↑;溶液变红;
②Y电极上反应产物为氯气,检验氯气的方法为:用润湿的KI淀粉试纸接近Y极气体产物,变蓝,证明产生Cl2气,
故答案为:用润湿的KI淀粉试纸接近Y极气体产物,变蓝,证明产生Cl2气;
③将电极Y换成铁棒,则Fe电极会失电子生成Fe2+,在阴极仍然为电解水,生成氢气和氢氧化钠,Fe2+与氢氧化钠反应生成氢氧化亚铁,所以可实现的实验目的是
制Fe(OH)2,
故答案为:制Fe(OH)2.
点评:本题考查了原电池原理和电解池原理的应用,涉及电极方程式的书写,物质的检验,电子转移的有关计算等,题目难度中等.

练习册系列答案
相关题目
将1L含有0.4mol CuSO4和0.2mol NaCl的水溶液用惰性电极电解,电解一段时间后,在一个电极上得到0.3mol Cu,另一个电极上产生气体(标况)的体积是( )
| A、4.48L |
| B、5.6L |
| C、6.72L |
| D、13.44L |
下列各组离子在指定溶液中,一定有大量共存的是( )
| A、pH=0的溶液中:Na+、[Al(OH)4]-、K+、NH4+ |
| B、由水电离出的c(H+)=10-12mol?L-1的溶液中:C1-、HCO3-、NH4+、SO32- |
| C、加入铝能离出H2的溶液中:Mg2+、NH4+、Cl-、SO42- |
| D、滴加石蕊试液显蓝色的溶液:K+、Ba2+、NO3-、OH- |
 有机物A是一种重要化工生产的中间体,己知结构简式如图:
有机物A是一种重要化工生产的中间体,己知结构简式如图: 已知:A、C、J为日常生活中常见的金属单质,其中A、C均呈银白色,J呈紫红色.A是地壳中含量最高的金属元素,B是一种红棕色金属氧化物.它们之间的转化关系如图.反应②在工业上可用于制作印刷电路板.请回答下列问题:
已知:A、C、J为日常生活中常见的金属单质,其中A、C均呈银白色,J呈紫红色.A是地壳中含量最高的金属元素,B是一种红棕色金属氧化物.它们之间的转化关系如图.反应②在工业上可用于制作印刷电路板.请回答下列问题: