题目内容
以NA表示阿佛加德罗常数,下列说法中正确的是( )
| A、53g碳酸钠中含NA个CO32- |
| B、标准状况下11.2L臭氧中含NA个氧原子 |
| C、1.8g水中含NA个中子 |
| D、0.1molOH-含NA个电子 |
考点:阿伏加德罗常数
专题:
分析:A.53g碳酸钠的物质的量为0.5mol;
B.标况下,11.2L臭氧物质的量是0.5mol;
C.1mol水含有8mol中子;
D.1molOH-含10mol电子.
B.标况下,11.2L臭氧物质的量是0.5mol;
C.1mol水含有8mol中子;
D.1molOH-含10mol电子.
解答:
解:A.53g碳酸钠的物质的量为0.5mol,含有0.5mol碳酸根离子,含0.5NA个CO32-,故A错误;
B.标况下,11.2L臭氧物质的量是0.5mol,含有1.5mol氧原子,故B错误;
C.1.8g水的物质的量是0.1mol,1mol水含有8mol中子,1.8g水含0.8mol,含0.8NA个中子,故C错误;
D.1molOH-含10mol电子,故0.1molOH-含1mol电子,即1NA个电子,故D正确.
故选D.
B.标况下,11.2L臭氧物质的量是0.5mol,含有1.5mol氧原子,故B错误;
C.1.8g水的物质的量是0.1mol,1mol水含有8mol中子,1.8g水含0.8mol,含0.8NA个中子,故C错误;
D.1molOH-含10mol电子,故0.1molOH-含1mol电子,即1NA个电子,故D正确.
故选D.
点评:本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.

练习册系列答案
相关题目
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系,下列有关说法正确的是( )


| A、c点对应的溶液中大量存在的离子可能为:Na+、Al3+、Cl-、CO32- |
| B、将25℃时的NaCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 |
| C、t℃>25℃ |
| D、ac线上的任意一点均有pH=7 |
在合成氨工业中,为增加氨气的日产量,在过程中与平衡移动无关的是( )
| A、不断分离出液氨 |
| B、使用催化剂 |
| C、采用500℃的高温 |
| D、采用20-50Mp的压强 |
已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+130kJ?mol-1
2C(s)+O2(g)=2CO(g)△H=-220kJ?mol-1.
其中H-H和O-H键的键能分别为436kJ?mol-1和462kJ?mol-1,则O=O键的键能为( )
2C(s)+O2(g)=2CO(g)△H=-220kJ?mol-1.
其中H-H和O-H键的键能分别为436kJ?mol-1和462kJ?mol-1,则O=O键的键能为( )
| A、496 kJ?mol-1 |
| B、248 kJ?mol-1 |
| C、428 kJ?mol-1 |
| D、284 kJ?mol-1 |
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
| A、9.5 | B、10.5 |
| C、11.5 | D、12.5 |
硫-钠原电池具有输出功率较高,循环寿命长等优点.其工作原理可表示为:2Na+xS
Na2Sx.但工作温度过高是这种高性能电池的缺陷,科学家研究发现,采用多硫化合物(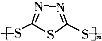 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
| 放电 |
| 充电 |
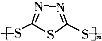 )作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )
)作为电极反应材料,可有效地降低电池的工作温度,且原材料价廉、低毒,具有生物降解性.下列有关叙述正确的是( )A、多硫化合物(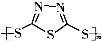 )是一种新型无机非金属材料 )是一种新型无机非金属材料 |
B、多硫化合物(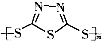 )化合物不能发生加成反应 )化合物不能发生加成反应 |
C、原电池的负极反应是将单体 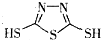 转化为 转化为 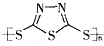 的过程 的过程 |
| D、当电路中有0.02mol电子通过时,原电池的负极将消耗原料0.46g |
设NA为阿伏加德罗常数,下列说法不正确的是( )
| A、1molNa变成Na+时失去的电子数为NA |
| B、12g12C中所含12C的数目为NA |
| C、CaCl2溶液中若含有1.5NA个Ca2+,则含有3NA个Cl- |
| D、11.2LN2中含有的氮原子数目为NA |
