题目内容
(14分)A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,B是短周期中金属性最强的元素,C是同周期中阳离子半径最小的元素,D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,E的最外层电子数与内层电子数之比为3﹕5。请回答:
(1)D的元素符号为 。
(2)F在元素周期表中的位置 。
(3)用电子式表示元素B与元素F形成的化合物: 。
(4)B单质与氧气反应的产物与C的单质同时放入水中,产生两种无色气体,有关的化学方程式为 、 。
(5)工业上将干燥的F单质通入熔融的E单质中可制得化合物E2F2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为 。
(6)某混合物的稀溶液中,只可能含有B、C、F构成的简单离子或A、E的最高价氧化物对应水化物所电离出来的阴离子。现分别取一定体积的该溶液进行实验。两次每次取200.00mL进行实验。
实验1:取2mL溶液,向其中加入AgNO3溶液有沉淀产生;
实验2:取200mL溶液,向其中加入足量BaCl2溶液后,得干燥沉淀12.54g,沉淀经足量盐酸洗涤、干燥后,剩余4.66g。请回答:
①根据以上实验,不能判断是否存在的离子有 。
② B的简单离子是否存在 ;若存在,浓度至少为 mol/L(若不存在,则不必回答第二问)。
(1)Si (1分)(2)第3周期,VIIA(2分)(3) (1分)
(1分)
(4)2Na2O2 + 2H2O=4NaOH + O2↑(2分) 2Al+ 2NaOH + 2H2O=2NaAlO2 +3H2↑(2分)
(5)2S2Cl2 + 2H2O == 3S + SO2↑+ 4HCl (2分)
(6) ①Cl- HCO3- (各1分,共2分)② 存在,0.6 (2分)
【解析】
试题分析:A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,则A是第二周期元素,因此A是碳元素。B是短周期中金属性最强的元素,则B是钠元素。C是同周期中阳离子半径最小的元素,原子序数大于钠,则C是铝元素。D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,所以D是硅元素。E的最外层电子数与内层电子数之比为3﹕5,则E是硫元素,所以F是氯元素。
(1)根据以上分析可知D的元素符号为Si。
(2)F的原子序数是17,在元素周期表中的位置第三周期第VIIA族。
(3)氯化钠是离子化合物,电子式为 。
。
(4)B单质与氧气反应的产物与C的单质同时放入水中,产生两种无色气体,这说明钠与氧气的产物是过氧化钠,过氧化钠溶于水生成氢氧化钠和氧气。氢氧化钠与铝反应生成偏氯酸钠和氢气,有关的化学方程式为2Na2O2 + 2H2O=4NaOH + O2↑、2Al+ 2NaOH + 2H2O=2NaAlO2 +3H2↑。
(5)工业上将干燥的F单质通入熔融的E单质中可制得化合物E2F2,该物质可与水反应生成一种能使品红溶液褪色的气体,该气体是SO2。0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变。在S2Cl2中S元素的化合价+1价,所以化合价发生变化的元素是S,氧化产物是SO2,还原产物是S,该反应的化学方程式为2S2Cl2 + 2H2O=3S + SO2↑+ 4HCl。
(6)实验1:取2mL溶液,向其中加入AgNO3溶液有沉淀产生,说明含有氯离子或硫酸根离子或碳酸根离子;实验2:取200mL溶液,向其中加入足量BaCl2溶液后,得干燥沉淀12.54g,沉淀经足量盐酸洗涤、干燥后,剩余4.66g,这说明4.66g沉淀是;硫酸钡,物质的量是0.02mol,碳酸钡的质量是12.54g—4.66g=7.88g,物质的量是0.04mol,一定含有硫酸根和碳酸根,则一定没有铝离子。根据溶液的电中性可知一定含有钠离子。
①根据以上分析可知,不能判断是否存在的离子有Cl-、HCO3-。
②根据以上分析可知,钠离子一定存在。由于硫酸根和碳酸根的浓度分别是0.1mol/L、0.2mol/L,而氯离子与碳酸氢根离子不能确定,所以根据电荷守恒可知钠离子浓度至少为0.1mol/L×2+0.2mol/L×2=0.6mol/L。
考点:考查元素推断的有关应用

(11分)电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为_________。
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是__________(填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
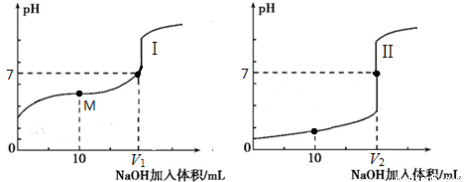
①滴定醋酸的曲线是_____(填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____。
③V1和V2的关系:V1_____V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_________。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
①写出步骤2中溶液变红色的离子方程式__________________。
②步骤3中现象a是_____________________。
③用化学平衡原理解释步骤4的实验现象______________________。
(15分)黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m 1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。

其反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
4FeS + 7O2 2Fe2O3+4SO2
2Fe2O3+4SO2
【实验一】测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:

(1)鼓入空气的作用是________________________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)_________。H2O2可以看作是一种很弱的酸,写出其电离方程式: 。
(3)该黄铁矿石中硫元素的质量分数为 (列出表达式即可)。
【实验二】测定铁元素的含量

(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量_______(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。


 。则有机物
。则有机物 的二氯代物有
的二氯代物有 )的废水可以通过构成微生物电池除去,其原理如下图所示。
)的废水可以通过构成微生物电池除去,其原理如下图所示。
