题目内容
11.A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期.C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙.A原子的最外层电子数比次外层电子数多3个.E是地壳中含量最高的金属元素.根据以上信息回答下列问题:(1)A元素在周期表中的位置是第二周期 第 VA族,乙物质的晶体中所含化学键的类型为离子键、共价键 ,用电子式表示甲的形成过程
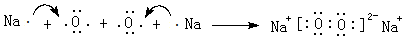 ,工业冶炼单质E的化学方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
,工业冶炼单质E的化学方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是Na>Mg>Al>N>O (用元素符号填写).
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑
(4)D的金属性比E的金属性强(填“强”或“弱”);哪些事实可以说明(写出一个即可)同条件下Mg与酸的反应比Al与酸反应剧烈,.
分析 A、B、C、D、E都是短周期元素,原子序数逐渐增大,A原子的最外层电子数比次外层电子层多3个,原子只能有2个电子层,最外层电子数为5,故A为N元素;E是地壳中含量最高的金属元素,则E为Al;A、B处于同一周期,C、D、E同处另一周期,即A、B处于第二周期,C、D、E处于第三周期,C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则C是Na元素,B是O元素,甲是Na2O,乙是Na2O2,D的原子序数介于Na、Al之间,故D为Mg.
解答 解:A、B、C、D、E都是短周期元素,原子序数逐渐增大,A原子的最外层电子数比次外层电子层多3个,原子只能有2个电子层,最外层电子数为5,故A为N元素;E是地壳中含量最高的金属元素,则E为Al;A、B处于同一周期,C、D、E同处另一周期,即A、B处于第二周期,C、D、E处于第三周期,C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则C是Na元素,B是O元素,甲是Na2O,乙是Na2O2,D的原子序数介于Na、Al之间,故D为Mg.
(1)A为氮元素,处于周期表中第二周期VA族,乙是Na2O2,含有离子键、共价键,用电子式表示其形成过程为: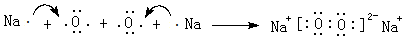 ,工业上电解熔融氧化铝冶炼Al,反应的化学方程式:2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,
,工业上电解熔融氧化铝冶炼Al,反应的化学方程式:2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,
故答案为:第二周期 第 VA族;离子键、共价键;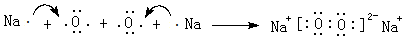 ;2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
;2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Mg>Al>N>O,
故答案为:Na>Mg>Al>N>O;
(3)E的单质为Al,C的最高价氧化物对应的水化物为NaOH,二者反应生成偏铝酸钠与氢气,发生反应的离子方程式是:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)同周期自左而右金属性减弱,则Mg的金属性比Al的强,相同条件下Mg与酸的反应比Al与酸反应剧烈,可以说明Mg的金属性更强,
故答案为:强;同条件下Mg与酸的反应比Al与酸反应剧烈.
点评 本题考查位置结构性质关系应用,元素的推断是答题的关键,注意金属性、非金属性强弱比较实验事实.

| A. | 糖类是具有甜味的物质 | |
| B. | 糖类是具有Cn(H2O)m通式的物质 | |
| C. | 淀粉是一种白色粉末,本身没有甜味 | |
| D. | 葡萄糖是一种单糖的主要原因是含有醛基 |
| A. | 14g乙烯和丙烯混合气体中的原子数为2NA | |
| B. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为3NA | |
| D. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA |
| A. | 检验NH4+:滴入NaOH溶液后,加热,用湿润红色石蕊试纸检验发现变蓝 | |
| B. | 检验Cl-:确定溶液中无SO42-后,加入AgNO3溶液后出现白色沉淀 | |
| C. | 检验Na+:将干净的铂丝蘸取少量溶液在酒精灯上灼烧,观察火焰呈浅紫色 | |
| D. | 检验SO42-:加入BaCl2溶液出现白色沉淀,再加足量稀盐酸沉淀不溶解 |
| A. | KNO3是还原剂,其中N元素被氧化 | |
| B. | 生成物中的N2是氧化产物,K2O是还原产物 | |
| C. | 当氧化产物比还原产物多2.8g时,转移电子$\frac{1}{14}$ mol | |
| D. | 氧化剂与还原剂的物质的量之比5:1 |
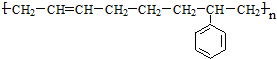

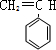 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$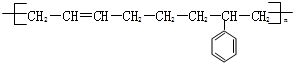 .
.