题目内容
20.氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23%=35.453中( )| A. | 75.77%表示35Cl的质量分数 | |
| B. | 24.23%表示35Cl在自然界所占的原子个数百分比 | |
| C. | 35.453表示氯元素的相对原子质量 | |
| D. | 36.966表示37Cl的质量数 |
分析 元素的近似相对原子质量=各核素的质量数×原子百分比,据此结合其原子百分比计算出A的近似相对原子质量,根据同位素、丰度、质量数、元素的相对原子质量、原子的相对原子质量的概念来回答即可.
解答 解:A、75.77%表示35Cl的丰度,即在自然界所占的原子个数百分比,不是质量分数,故A错误;
B、24.23%表示37Cl在自然界所占的原子个数百分比,而不是35Cl在自然界所占的原子个数百分比,故B错误;
C、元素的相对原子质量=各元素的质量数×原子百分比,35.5表示氯元素的相对原子质量,故C正确;
D、36.966表示37Cl的相对原子质量,不是37Cl的质量数,故D错误.
故选C.
点评 此题需要学生对于某些容易混淆的基本概念有准确的理解,体现了高考立足于基础知识的特点.

练习册系列答案
相关题目
10.已知34Se的原子结构示意图为 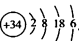 下列说法正确的是( )
下列说法正确的是( )
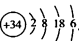 下列说法正确的是( )
下列说法正确的是( )| A. | Se位于第4周期第ⅣA族 | B. | 原子半径:Br>Se>P | ||
| C. | 热稳定性:HCl>H2Se>HBr | D. | 酸性:HClO4>HBrO4>H2SeO4 |
11.用下列实验装置进行相应实验,能达到实验目的是( )
| A. | 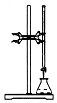 用标准氢氧化钠溶液滴定未知浓度的盐酸 | |
| B. | 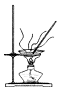 加热FeCl3溶液获取FeCl3固体 | |
| C. | 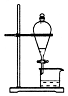 用酒精萃取碘水中的碘 | |
| D. | 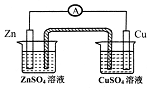 通过原电池原理证明金属性Zn>Cu |
8.化学与生活有密切联系,下列说法正确的是( )
| A. | 酸雨易导致土壤胶粒吸附H+使土壤酸化,影响铵态氮肥和钾肥的有效利用 | |
| B. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| C. | 高纯度的单晶硅用于制造登月车的光电池和光导纤维 | |
| D. | 铝及其合金是电气、工业、家庭广泛使用的材料,通常用电解氯化铝的方法制取铝 |
15.下列各组中两种微粒所含电子数不相等的是( )
| A. | S2-和Al3+ | B. | CO和N2 | C. | H3O+和OH- | D. | NH3和NH4+ |
5.下列说法中正确的是( )
| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | 乳酸分子[CH3-CH(OH)-COOH]中有 1 个手性碳且 1 mol 该分子中有 11 mol σ 键 | |
| C. | PCl5分子中P原子和Cl原子最外层都满足8电子结构 | |
| D. | H-O键键能为463 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ |
12. 我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法不正确的是( )
我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法不正确的是( )
 我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法不正确的是( )
我国科研人员研制出一种室温“可呼吸”Na-CO2电池.放电时该电池“吸入”CO2,充电时“呼出”CO2.吸入CO2时,其工作原理如图所示.吸收的全部CO2中,有$\frac{2}{3}$转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面.下列说法不正确的是( )| A. | 每“呼出”22.4LCO2,转移电子数为$\frac{4}{3}$mol | |
| B. | “吸入”CO2时的正极反应:4Na++3CO2+4e-=2Na2CO3+C | |
| C. | “呼出”CO2时钠箔电极反应式是Na++e-=Na | |
| D. | 放电时电池总反应是4Na+3CO2=2Na2CO3+C |
2.化学与科学、技术、社会、环境密切关.下列叙述不正确的是( )
| A. | 大气中PM2.5比表面积大,吸附力强,能吸附许多有毒、有害物质 | |
| B. | Na2S具有还原性,作废水中Cu2+、Hg2+沉淀剂 | |
| C. | 石墨烯一种由单层碳原子构成的新纳米材料,具有导电性 | |
| D. | 刚玉、红宝石主要或分是氧化铝,陶瓷、分子筛主要成分是硅酸盐 |
