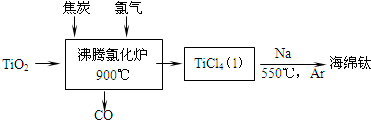
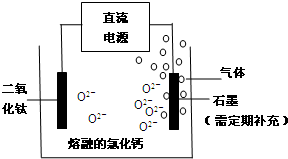
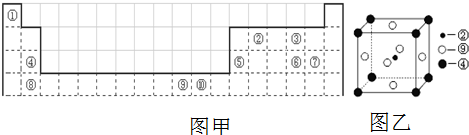
题目内容
钢铁表面容易发生电化学腐蚀,发生吸氧腐蚀时,铁是 极,电极反应式为 ,杂质碳是 极,电极反应式为 .
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:钢铁中含有Fe、C,C、Fe和电解质溶液构成原电池,Fe易失电子作负极,C为正极,负极上铁失电子发生氧化反应生成亚铁离子,正极上氧气得电子发生还原反应,据此分析解答.
解答:
解:钢铁中含有Fe、C,C、Fe和电解质溶液构成原电池,Fe易失电子作负极,电极反应式为Fe-2e-=Fe2+,C为正极,正极上氧气 得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故答案为:负;Fe-2e-=Fe2+;正;O2+2H2O+4e-=4OH-.
点评:本题考查金属的腐蚀与防护,明确原电池原理即可解答,知道正负极的判断、正负极上发生的电极反应,会正确书写电极反应式,知道析氢腐蚀和吸氧腐蚀的区别.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、1.0 mol?L-1KNO3溶液:H+、Fe 2+、SCN -、SO42- | ||
| B、pH=0的溶液:Al3+、Cu(NH3)42+、F -、SO42- | ||
| C、c(ClO-)=1.0mol?L-1的溶液:Na+、SO32-、S2-、SO42- | ||
D、
|
一定条件下,向含HNO3的废水中加入CH3OH进行污水处理,发生反应5CH3OH+6HNO3=3N2↑+5CO2↑+13H2O,下列说法正确的是( )
| A、CH3OH被氧化,表现氧化性 |
| B、此条件下还原性强弱为:N2>CH3OH |
| C、若氧化产物比还原产物多0.2mol,则该反应中转移3mol |
| D、该反应过程中断裂的化学键既有极性键又有非极性键 |
常温下,下列物质的水溶液,其pH值大于7的是( )
| A、KNO3 |
| B、NaHSO4 |
| C、NH4Br |
| D、NaF |
已知:A(g)+O2(g)═AO2(g)△H=-393.5kJ/mol;2B2(g)+O2(g)═2B2O(g)△H=-483.6kJ/mol.现有0.4mol的A和B2组成的混合气,在氧气中完全燃烧,共放出127.06kJ热量,则混合物中A与B2的物质的量之比为( )
| A、2:3 | B、1:2 |
| C、1:1 | D、3:2 |
若20g密度为ρ g?cm-3的硝酸钙溶液里含1g Ca2+,则NO3-的物质的量浓度是( )
A、
| ||
B、
| ||
| C、2.5ρ mol?L-1 | ||
| D、1.25ρ mol?L-1 |