题目内容
常温下,下列物质的水溶液,其pH值大于7的是( )
| A、KNO3 |
| B、NaHSO4 |
| C、NH4Br |
| D、NaF |
考点:水的电离,溶液pH的定义
专题:电离平衡与溶液的pH专题
分析:常温下,物质的水溶液pH大于7,说明该溶液中的溶质为碱、强碱弱酸盐,据此分析解答.
解答:
解:A.硝酸钾是强酸强碱盐,在水溶液里不水解,其溶液呈中性,故A错误;
B.硫酸氢钠在水溶液里电离,电离方程式为NaHSO4=Na++H++SO42-,溶液中含有大量氢离子而使溶液呈强酸性,故B错误;
C.NH4Br为强酸弱碱盐,铵根离子水解导致溶液呈酸性,故C错误;
D.NaF为强碱弱酸盐,氟离子水解导致溶液呈碱性,故D正确;
故选D.
B.硫酸氢钠在水溶液里电离,电离方程式为NaHSO4=Na++H++SO42-,溶液中含有大量氢离子而使溶液呈强酸性,故B错误;
C.NH4Br为强酸弱碱盐,铵根离子水解导致溶液呈酸性,故C错误;
D.NaF为强碱弱酸盐,氟离子水解导致溶液呈碱性,故D正确;
故选D.
点评:本题考查溶液酸碱性判断,明确物质的性质即可解答,注意不能根据pH判断溶液酸碱性,只能根据氢离子和氢氧根离子浓度相对大小确定溶液酸碱性,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
相同温度、相同浓度下的六种电解质溶液,其pH由小到大的顺序如图所示,图中:①②③代表的物质可能分别为( )
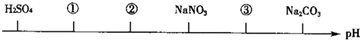
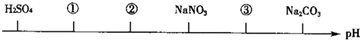
| A、NH4Cl;(NH4)2SO4;CH3COONa |
| B、(NH4)2SO4;NH4Cl;CH3COONa |
| C、(NH4)2SO4;NH4Cl;NaOH |
| D、CH3COOH;NH4Cl;(NH4)2SO4 |
下列反应的离子方程式正确的是( )
| A、将SO2通入氯水中:SO2+Cl2+H2O=2H++SO42-+2Cl- |
| B、氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
| C、硅酸钠溶液中通入CO2气体:SiO32-+CO2+H2O=H2SiO3↓+CO32- |
| D、碳酸氢钠和稀硫酸反应:CO3-+2H+═CO2↑+H2O |
萃取碘水中碘时,选用CCl4作为萃取剂理由不正确的是( )
| A、CCl4与原溶剂水互不溶解 |
| B、CCl4与水和碘都不发生化学反应 |
| C、CCl4是有机溶剂,且密度比水大 |
| D、碘在CCl4中的溶解度比在水中的大得多 |
下列状态的物质,既能导电又属于电解质的是( )
| A、氯化镁晶体 |
| B、氯化钠溶液 |
| C、液态氯化氢 |
| D、熔融氢氧化钾 |
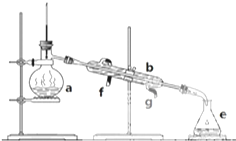 掌握仪器名称、组装及使用方法是中学化学实验的基础,图为实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,图为实验装置.