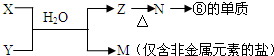题目内容
16.黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.(1)冶炼铜的反应为8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是Cu、O(填元素符号).
(2)上述冶炼过程中产生大量SO2.下列处理方案合理的是bc(填代号).
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、Al2O3及不溶于强酸的SiO2)可制备Fe2O3.
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得.
据以上信息回答下列问题:
a.除去Al3+的离子方程式是Al3++4OH-=2H2O+AlO2-.
b.步骤②中滤液氧化的目的是将Fe2+氧化为Fe3+.
c.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水所选试剂为稀硫酸、KMnO4溶液.
证明炉渣中含有FeO的实验现象为稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色.
分析 (1)8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2中,Fe元素的化合价升高,Cu、O元素的化合价降低;
(2)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收;
(3)a、氧化铝是两性氧化物,能和强酸以及强碱反应,利用氢氧化钠使其变为偏铝酸根即可;
b、步骤②中滤液氧化将亚铁离子氧化成铁离子,生成氢氧化铁、干燥、煅烧得氧化铁;
c、亚铁离子能被高锰酸钾溶液氧化,使的高锰酸钾溶液褪色.
解答 解:(1)8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2中,Fe元素的化合价升高,Cu、O元素的化合价降低,则Cu、O元素被还原,
故答案为:Cu、O;
(2)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收,与浓硫酸不反应,也不能直接排放,
故答案为:bc;
(3)a.氧化铝是两性氧化物,能和强酸以及强碱反应,6H++Al2O3=3H2O+2Al3+,除去铝离子的反应是利用过量氢氧化钠溶液和铝离子反应生成偏铝酸根,
故答案为:Al3++4OH-=2H2O+AlO2-;
b.步骤②中滤液氧化将亚铁离子氧化成铁离子,生成氢氧化铁、干燥、煅烧得氧化铁,
故答案为:将Fe2+氧化为Fe3+;
c.酸性高锰酸钾溶液能氧化亚铁离子,使得高锰酸钾溶液褪色,用硫酸酸化高锰酸钾,
故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色.
点评 本题是对金属的化学性质的考查,要求学生熟记教材知识,学以致用,综合性较强,难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
7.下列说法不正确的是( )
| A. | 同温、同压下,相同质量的气体都占有相同的体积 | |
| B. | 同温、同压下,相同体积的气体都含有相同数目的分子 | |
| C. | 1molO2中含有1.204×1024个氧原子,在标准状况下占有体积22.4L | |
| D. | 由0.2g H2和8.8g CO2、5.6g CO组成混合气体,其密度是相同状况下O2密度的0.913倍 |
4.下列说法正确的是( )
| A. | 溶液和胶体的本质区别是能否产生丁达尔现象 | |
| B. | FeCl3溶液呈电中性,Fe(OH)3胶体带正电 | |
| C. | 江河入海口处易形成三角洲,这与胶体的性质有关 | |
| D. | 胶体的分散质不能通过滤纸 |
11.进行化学实验操作必须正确、规范.下列说法中不正确的是( )
| A. | 用滴管滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁 | |
| B. | 用药匙或者纸槽把粉末状药品送入试管的底部 | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 | |
| D. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
1.常温时,下列叙述正确的是( )
| A. | 1mL pH=10的氨水和100mLpH=4的甲酸溶液导电性相同 | |
| B. | pH均为5的HCl和NH4Cl溶液中,水的电离程度相同 | |
| C. | 稀释pH=10的氨水,溶液中所有离子的浓度均降低 | |
| D. | 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
8.下列离子方程式中,正确的是( )
| A. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氯化铁溶液与铁反应:Fe3++Fe═2Fe2+ | |
| C. | 氧化亚铁与稀盐酸反应:FeO+2H+═Fe3++H2O | |
| D. | 氯化铁溶液与铜反应:2Fe3++Cu═2Fe2++Cu2+ |
5.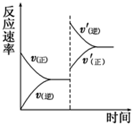 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )
 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )| A. | 正反应是吸热反应,m+n>p+q | B. | 逆反应是吸热反应,m+n>p+q | ||
| C. | 正反应是吸热反应,m+n<p+q | D. | 逆反应是吸热反应,m+n<p+q |
6.欲使0.1mol•L-1Na2S溶液中,$\frac{c(H{S}^{-})}{c({S}^{2-})}$的值减小,可采取的措施是( )
| A. | 加入适量等浓度的NaOH溶液 | B. | 加入适量水 | ||
| C. | 通入适量H2S气体 | D. | 加入适量等浓度的NaHS溶液. |
 .
.