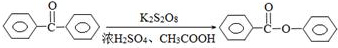题目内容
7.下列说法不正确的是( )| A. | 同温、同压下,相同质量的气体都占有相同的体积 | |
| B. | 同温、同压下,相同体积的气体都含有相同数目的分子 | |
| C. | 1molO2中含有1.204×1024个氧原子,在标准状况下占有体积22.4L | |
| D. | 由0.2g H2和8.8g CO2、5.6g CO组成混合气体,其密度是相同状况下O2密度的0.913倍 |
分析 A、根据公式m=nM=$\frac{V}{Vm}$M来判断;
B、根据阿伏伽德罗定律的内容:同温、同压下,相同体积的气体都含有相同数目的分子来回答;
C、根据公式N=nNA结合分子的原子构成情况来回答;
D、根据n=$\frac{m}{M}$计算各气体的物质的量,再根据M=$\frac{m}{n}$计算平均摩尔质量,相同条件下气体密度之比等于其摩尔质量之比,据此计算解答.
解答 解:A、根据公式m=nM=$\frac{V}{Vm}$M,同温、同压下,气体的Vm是相等的,相同质量的气体的物质的量不一定相等,所以占有的体积不一定相等,故A错误;
B、阿伏伽德罗定律:同温、同压下,相同体积的气体都含有相同数目的分子,故B正确;
C、1molO2中含有2mol级1.204×1024个氧原子,在标准状况下占有体积V=nVm=22.4L,故C正确;
D、0.2g H2的物质的量为0.1mol,8.8g CO2的物质的量为0.2mol,5.6gCO的物质的量为0.2mol,故混合气体的平均摩尔质量为$\frac{0.2+8.8+5.6}{0.1+0.2+0.2}$g/mol=29.2g/mol,
混合气体密度是相同条件下O2的密度的$\frac{29.2}{32}$=0.913倍,故D正确.
故选A.
点评 本题考查学生物质的量以及阿伏伽德罗定律的应用知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
17.利用如图所示装置进行下列实验,将X溶液逐滴加入固体Y中,装置B的试管中的现象不
正确的是( )
正确的是( )
| 选项 | X溶液 | 固体Y | Z溶液 | 现象 |  |
| A | 稀硫酸 | 亚硫酸氢钠 | 品红试剂 | 品红褪色 | |
| B | 浓氨水 | CaO | 紫色石蕊试液 | 溶液变红 | |
| C | 盐酸 | 石灰石 | 硅酸钠溶液 | 出现白色沉淀 | |
| D | 双氧水 | MnO2 | 氢硫酸溶液 | 产生浑浊 |
| A. | A | B. | B | C. | C | D. | D |
18.某反应过程中的能量变化如图所示,则该反应的△H为( )


| A. | △H>0 | B. | △H<0 | C. | △H=0 | D. | 无法判断 |
15.某离子反应中涉及H2O、ClO?、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图所示.下列判断正确的是( )

| A. | 该反应的还原剂是Cl- | |
| B. | 消耗1 mol还原剂,转移6 mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
12.(1)不同温度下水的离子积常数如表所示:
请用文字解释随温度升高水的离子积增大的原因:水电离吸热,升高温度后平衡正向移动;
10℃时纯水的电离平衡常数为5.3×10-17;
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如下表数据:
向NaCN溶液中通入少量CO2,所发生反应的化学方程式为CO2+H2O+NaCN═NaHCO3+HCN.
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| KW/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
10℃时纯水的电离平衡常数为5.3×10-17;
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如下表数据:
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=5.0×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
 苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.
苯甲酸苯酯是重要的有机合成中间体,工业上用二苯甲酮制备苯甲酸苯酯.