题目内容
14.下列过程光能变为电能的是( )| A. | 镁条燃烧 | B. | 光伏发电 | C. | 光合作用 | D. | 电解冶钠 |
分析 化学反应中存在化学能与热点、电能的转化,太阳能可直接转化为电能、化学能等,结合反应的特点解答该题.
解答 解:A.镁条燃烧,发生化学变化,化学能转化为热能,故A不选;
B.光伏发电,将太阳能直接转化为电能,故B选;
C.光合作用将太阳能转化为化学能,故C不选;
D.电解冶钠将电能转化为化学能,故D不选.
故选B.
点评 本题考查常见能量的转化,为高频考点,侧重考查学生的双基,有利于培养学生良好的科学素养,难度不大,注意把握能量的转化特点.

练习册系列答案
相关题目
16.H、C、N、O、Na、Al、S、Cl、Ca是常见的9种元素.
(1)写出由上述9种元素的几种组成的既含有离子键又含共价键的离子化合物的化学式NaOH(或NaClO、Na2O2等);既含极性共价键又含非极性共价键的共价化合物的化学式H2O2(或C2H4、N2H4).
(2)O元素的一种中子数为10的核素的符号表示为818O,N的原子结构示意图 .
.
(3)上述9种元素中的金属工业冶炼方法是A
A.全部采用电解法
B.其中2种采用电解法,另外一种采用热分解法
C.其中一种采用电解法,另外两种采用热还原法
D.全部采用加热分解法
(4)用“大于”“小于”或“等于”填空
(5)甲与乙在溶液中的转化关系如右图所示(反应条件省略)甲不可能是D.
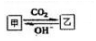
A.NH3 B.AlO2- C.CO32- D.CH3COO-
(6)CaCO3和适量HCl溶液反应,当反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化曲线如图所示.
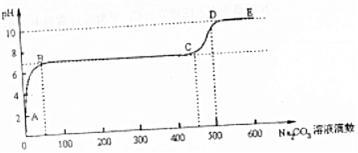
请用离子方程式表示B-C段发生的反应Ca2++CO32-=CaCO3↓;C点到D点pH增大的原因可用离子方程式表示为CO32-+H2O?HCO3-+OH-.
(1)写出由上述9种元素的几种组成的既含有离子键又含共价键的离子化合物的化学式NaOH(或NaClO、Na2O2等);既含极性共价键又含非极性共价键的共价化合物的化学式H2O2(或C2H4、N2H4).
(2)O元素的一种中子数为10的核素的符号表示为818O,N的原子结构示意图
 .
.(3)上述9种元素中的金属工业冶炼方法是A
A.全部采用电解法
B.其中2种采用电解法,另外一种采用热分解法
C.其中一种采用电解法,另外两种采用热还原法
D.全部采用加热分解法
(4)用“大于”“小于”或“等于”填空
| 离子半径 | 还原性 | 得电子能力 |
| N3-大于Al3+ | O2-小于S2- | 35Cl等于37Cl |

A.NH3 B.AlO2- C.CO32- D.CH3COO-
(6)CaCO3和适量HCl溶液反应,当反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化曲线如图所示.

请用离子方程式表示B-C段发生的反应Ca2++CO32-=CaCO3↓;C点到D点pH增大的原因可用离子方程式表示为CO32-+H2O?HCO3-+OH-.
6.有一在空气中暴露过的NaOH固体,经分析知其含H2O7.65%,含Na2CO34.32%,其余是NaOH.若将ag样品放入bmL1mol/L的盐酸,使其充分作用后,残留酸用25.52mLcmol/L的NaOH溶液恰好中和完全.则蒸发所得溶液,得到固体质量的表达式中(单位为克)( )
| A. | 应含有a | B. | 只含有b | C. | 比含有c | D. | 一定有a、b、c |
3.将容积为40mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5mL.则原混合气体中NO2和O2体积比可能是( )
| A. | 3:7 | B. | 7:1 | C. | 5:3 | D. | 1:1 |
4.a、b、c、d、e是原子序数依次增大的五种短周期主族元素.b、c、e最外层电子数之和为10;a原子核外最外层电子数是次外层的2倍;c是同周期中原子半径最大的元素;工业上一般通过电解氧化物的方法制备d的单质;e的单质是制备太阳能电池的重要材料.下列说法正确的是( )
| A. | a能将e从其氧化物中置换出来,因此非金属性a>e | |
| B. | b元素的气态氢化物易液化,是因为其分子间能形成氢键 | |
| C. | 工业上不用电解氯化物的方法制备单质d是由于其氯化物的熔点高 | |
| D. | 相同质量的c和d单质分别与足量稀盐酸反应,前者生成的氢气多 |