��Ŀ����
9�����ྻú�������о����������൱�ձ飬������Աͨ�������ú������¯�н�����������ˮ�����ķ��������������˸���ֵ��ú̿��������Ҫ�ɷ���CO��H2��CO��H2����Ϊ��Դ�ͻ���ԭ�ϣ�Ӧ��ʮ�ֹ㷺������ú̿���ķ�Ӧ֮һ�ǣ�C ��s��+H2O ��g��?CO��g��+H2��g����H=+131.4kJ/mol��1�����ݻ�Ϊ3L���ܱ������з���������Ӧ��5min��������������ܶ�������0.12g/L����H2O��ʾ0��5min��ƽ����Ӧ����Ϊ0.002mol/��L•min����
��2������������Ӧ�ڻ�ѧƽ��״̬ʱ��������ȷ����AC��
A��CO�ĺ������ֲ���
B��v����H2O��=v����H2��
C�������л�������ƽ����Է����������ֲ���
��3����������Ӧ��t0ʱ�̴ﵽƽ�⣨��ͼ1������t1ʱ�̸ı�ijһ����������ͼ1��������t1ʱ��֮������Ӧ������ʱ��ı仯������ʵ�߱�ʾ��
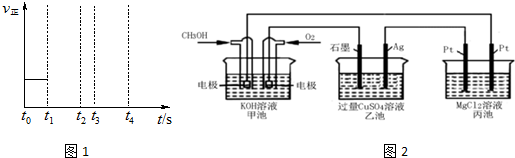
����С���������t2ʱ����ƽ�⣻��t3ʱƽ�ⳣ��Kֵ���t4����ƽ�⣮
��4����һ����������CO��H2�����Ƶü״���CH3OH��CO��ȼ����Ϊ��725.8kJ/mol��283.0kJ/mol��1molҺ̬ˮ�����̬ˮ����44.0kJ��д���״�����ȫȼ������һ����̼����̬ˮ���Ȼ�ѧ����ʽ��CH3OH��l��+O2��g��=CO��g��+2H2O��g����H=-354.8kJ�Mmol ��
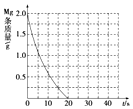
��5����ͼ2��ʾ���Լ״�ȼ�ϵ����Ϊ��Դʵ�����е����̣��ҳ��з�����Ӧ�����ӷ���ʽΪ2Cu2++2H2O$\frac{\underline{\;���\;}}{\;}$2Cu+O2+4H+�����׳�������16gʱ�������������ϲ����������������ֵΪ34.8g��
���� ��1�����ݷ�Ӧ����ʽ��֪���������ӵ�����Ϊ����̼������������m=��V�������Ӧ����̼������������������ʵ����������ݷ�Ӧ����ʽ����Ӧ���ʱ���ʽ�������H2O��ʾ0��5miin��ƽ����Ӧ���ʣ�
��2�����淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�����ֵ�Ũ�ȡ��ٷֺ������ٱ仯���ݴ˽����жϣ�
��3������Ӱ�컯ѧ��Ӧ���ʵ����ػ�������Ӧ���ʱ仯�����ߣ�
��4����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-283.0kJ•mol-1��-725.8kJ•mol-1��ˮ��Ħ��������Ϊ44.0 kJ/mol����
��CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-283.0kJ•mol-1
��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2 H2O��l����H=-725.8kJ•mol-1
��H2O��l��=H2O��g����H=-44KJ/mol
�ɸ�˹���ɿ�֪�â�-��+�ۡ�2�õ��Ȼ�ѧ����ʽ��
��5��ͼ2�м׳�Ϊԭ��أ�ͨ��״��ĵ缫Ϊ������ͭ�����ĵ缫Ϊ���������ҳ���ʯīΪ��������Ϊ��������Һ��ͭ���������缫�����������������ӵ�Pt�缫Ϊ��������һ���缫Ϊ�����������������ӵ�Pt�缫Ϊ��������һ���缫Ϊ�������缫��ӦΪ������2Cl--2e-=Cl2��������Ϊ2H++2e-=H2����MgCl2+2H2O$\frac{\underline{\;���\;}}{\;}$Mg��OH��2��+H2��+Cl2�����׳��з����ķ�ӦΪ��2CH3OH+3O2+4KOH=2K2CO3+6H2O����Һ�м״���������Ӧ������Һ��������ÿ��Ӧ2mol�״���3mol������Ӧ��Һ��������=2mol��32g/mol+3mol��32g/mol=160g������ת��Ϊ12mol�����׳�������16gʱ������ת��1.2mol�������غ�õ������������ϲ�������Ϊ������þ������
��� �⣺��1�����ݻ�Ϊ3L���ܱ������з���������Ӧ��5min��������������ܶ�������0.12g/L�����ݷ�ӦC��s��+H2O��g��?CO��g��+H2��g����֪���������ӵ�����Ϊ�μӷ�Ӧ�Ĺ���C����������Ӧ����̼�����ʵ���Ϊ��$\frac{0.12g/L��3L}{12g/mol}$=0.03mol���÷�Ӧ����������ˮ�����ʵ���ҲΪ0.03mol������H2O��ʾ0��5miin��ƽ����Ӧ����Ϊ��$\frac{0.03mol}{3L��5min}$=0.002mol/��L•min����
�ʴ�Ϊ��0.002mol/��L•min����
��2��A��CO�ĺ������ֲ�����ƽ���־����A��ȷ��
B����Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮��Ϊ����Ӧ����֮�ȣ�v����H2O��=v����H2������v����H2��=v����H2������Ӧ�ﵽƽ��״̬��v����H2O��=v����H2��������˵����Ӧ�ﵽƽ��״̬����B����
C�������������䣬�������ʵ������������л�������ƽ����Է����������ֲ��䣬˵����Ӧ�ﵽƽ��״̬����C��ȷ��
�ʴ�Ϊ��AC��
��3����t1ʱ��С�����������Ӧ��ϵ��ѹǿ�������淴Ӧ���ʶ�����ֱ��t2ʱ���´ﵽƽ�⣻
��t3ʱƽ�ⳣ��K����˵��ƽ�����������ƶ���˵���������¶ȣ�֮������Ӧ������С��ֱ���ﵽ�µ�ƽ�⣬
�������Ϸ���������ͼ��Ϊ�� ��
��
�ʴ�Ϊ�� ��
��
��4����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-283.0kJ•mol-1��-725.8kJ•mol-1����
��CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-283.0kJ•mol-1
��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2 H2O��l����H=-725.8kJ•mol-1
��H2O��l��=H2O��g����H=-44KJ/mol
�ɸ�˹���ɿ�֪�â�-��+�ۡ�2�÷�ӦCH3OH��l��+O2��g��=CO��g��+2 H2O��g�����÷�Ӧ�ķ�Ӧ�ȡ�H=-725.8kJ•mol-1-��-283.0kJ•mol-1��+2��44KJ/mol=-354.8kJ•mol-1��
�ʴ�Ϊ��CH3OH ��l��+O2��g��=CO ��g��+2H2O ��g����H=-354.8 kJ�Mmol��
��5��ͼ2�м׳�Ϊԭ��أ�ͨ��״��ĵ缫Ϊ������ͭ�����ĵ缫Ϊ���������ҳ���ʯīΪ��������Ϊ��������Һ��ͭ���������缫������Cu2++2e-=Cu�������������������ӷŵ��������������Ե缫��ӦΪ��4OH--4e-=2H2O+O2������ط�Ӧ�����ӷ���ʽΪ��2Cu2++2H2O$\frac{\underline{\;���\;}}{\;}$2Cu+O2+4H+�������������ӵ�Pt�缫Ϊ��������һ���缫Ϊ�������缫��ӦΪ������2Cl--2e-=Cl2��������Ϊ2H++2e-=H2����MgCl2+2H2O$\frac{\underline{\;���\;}}{\;}$Mg��OH��2��+H2��+Cl2�����׳��з����ķ�ӦΪ��2CH3OH+3O2+4KOH=2K2CO3+6H2O����Һ�м״���������Ӧ������Һ��������ÿ��Ӧ2mol�״���3mol������Ӧ��Һ��������=2mol��32g/mol+3mol��32g/mol=160g������ת��Ϊ12mol�����׳�������16gʱ������ת��1.2mol�������غ�õ������������ϲ�������Ϊ������þ�����ݻ�ѧ����ʽ������1mol������þ������ת��2mol���ӣ������ת��1.2mol�����ɳ���������þ0.6mol������õ����ʵ���Ϊ����=0.6mol��58g/mol=34.8g��
�ʴ�Ϊ��2Cu2++2H2O$\frac{\underline{\;���\;}}{\;}$2Cu+O2+4H+��34.8��
���� ���⿼���Ϊ�ۺϣ�Ϊ�߿��������ͣ����ؿ���ѧ���ķ��������ͼ����������漰��ѧƽ��ļ��㡢��ѧƽ��״̬���жϡ���ѧƽ���Ӱ�����ء����غ�ԭ���ԭ���ļ����֪ʶ����Ŀ�Ѷ��еȣ���ȷӰ�컯ѧ��Ӧ���ʵ�����Ϊ���ؼ�����

 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�| ʵ����� | �� | �� | �� | �� | �� |
| ����������g�� | 3.06 | 6.12 | 9.18 | 12.24 | 15.30 |
| Ba��OH��2��Һ�����mL�� | 300 | 300 | 300 | 300 | 300 |
| ���ɳ�����������g�� | 5.19 | 11.82 | 17.73 | 23.64 | 23.64 |
��1����Ʒ��KHCO3��Na2CO3�����ʵ���֮��2��1��
��2�������µڢ���ʵ��������Һ�е�OH-���ʵ���Ũ��Ϊ0.2mol/L��
| A�� | 2mol������1mol���������������ԼΪ2��1 | |
| B�� | 2mol������1mol��������������ԼΪ1��1 | |
| C�� | 1mol������3mol��������������ԼΪ1��3 | |
| D�� | 1mol������3mol����������ܶȱ�ԼΪ1��3 |
| A�� | þ��ȼ�� | B�� | ������� | C�� | ������� | D�� | ���ұ�� |
| A�� | ���������CO2��SO2��H2O | B�� | ���������Na2O��CaO��P2O5 | ||
| C�� | �NaOH��KOH��Ba��OH��2 | D�� | ���NH4Cl��NH4NO3����NH4��2SO4 |
 Ϊ��̽��þ�������ᡢ���ᷴӦʱ��Ũ�Ȼ��¶ȶԷ�Ӧ���ʣ��۲�þ����ʧ��ʱ�䣩��Ӱ�죬�������»�ѧ��Ʒ��0.20mol•L-1��0.40mol•L-1��HCl��Һ��0.20mol•L-1��0��.40mol•L-1��CH3COOH��Һ��4��þ������״����С��������ͬ������֧�Թܺͽ�ͷ�ιܣ���Һ�¶ȿ���Ϊ298K��308K��
Ϊ��̽��þ�������ᡢ���ᷴӦʱ��Ũ�Ȼ��¶ȶԷ�Ӧ���ʣ��۲�þ����ʧ��ʱ�䣩��Ӱ�죬�������»�ѧ��Ʒ��0.20mol•L-1��0.40mol•L-1��HCl��Һ��0.20mol•L-1��0��.40mol•L-1��CH3COOH��Һ��4��þ������״����С��������ͬ������֧�Թܺͽ�ͷ�ιܣ���Һ�¶ȿ���Ϊ298K��308K������Һ��ȡ��������ͬ�������������������ʵ����Ʊ���
| ʵ�� ��� | �¶ȣ�K�� | ����Ũ��/ ��mol•L-1�� | ����Ũ��/ ��mol•L-1�� | ʵ��Ŀ�� |
| a | 298 | 0.20 | I��ʵ��a��b��̽���¶� ��þ�����ᷴӦ���ʵ�Ӱ�죻 II��ʵ��a��c��̽��Ũ�� ��þ�����ᷴӦ���ʵ�Ӱ�죻 III��ʵ��a��d��̽����ͬ�¶��£���ͬŨ�ȵ����ᡢ������þ��Ӧ���ʵ����� | |
| b | 308 | 0.20 | ||
| c | 298 | 0.40 | ||
| d | -- | -- |
���裺�÷�Ӧ�¶�ÿ����10�棬��Ӧ������ԭ����2�����¶���ͬʱ����������ͬŨ������ƽ���ٶȵ�$\frac{1}{2}$�����ڴ�ͼ�д��»�����ʵ��b������ʵ��d����þ��ʣ��������ʱ���ϵ���ߣ���ע���Ҫ�ı�ע��
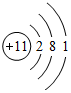 ��B���ӵĵ���ʽ
��B���ӵĵ���ʽ ��Cԭ�ӵ�������ԭ�ӣ�Dԭ�ӵĵ���ʽ
��Cԭ�ӵ�������ԭ�ӣ�Dԭ�ӵĵ���ʽ ��
��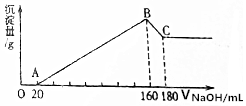 ��һ��������þ�����Ͻ�Ͷ��200mLһ��Ũ�ȵ������У��Ͻ���ȫ�ܽ⣬��������Һ�еμ�5mol/L NaOH��Һ�����ɵij������������NaOH��Һ�����ͼ��ʾ��
��һ��������þ�����Ͻ�Ͷ��200mLһ��Ũ�ȵ������У��Ͻ���ȫ�ܽ⣬��������Һ�еμ�5mol/L NaOH��Һ�����ɵij������������NaOH��Һ�����ͼ��ʾ��