题目内容
16.H、C、N、O、Na、Al、S、Cl、Ca是常见的9种元素.(1)写出由上述9种元素的几种组成的既含有离子键又含共价键的离子化合物的化学式NaOH(或NaClO、Na2O2等);既含极性共价键又含非极性共价键的共价化合物的化学式H2O2(或C2H4、N2H4).
(2)O元素的一种中子数为10的核素的符号表示为818O,N的原子结构示意图
 .
.(3)上述9种元素中的金属工业冶炼方法是A
A.全部采用电解法
B.其中2种采用电解法,另外一种采用热分解法
C.其中一种采用电解法,另外两种采用热还原法
D.全部采用加热分解法
(4)用“大于”“小于”或“等于”填空
| 离子半径 | 还原性 | 得电子能力 |
| N3-大于Al3+ | O2-小于S2- | 35Cl等于37Cl |
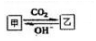
A.NH3 B.AlO2- C.CO32- D.CH3COO-
(6)CaCO3和适量HCl溶液反应,当反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化曲线如图所示.
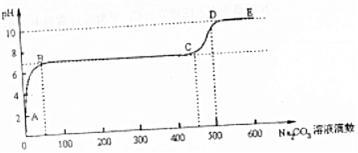
请用离子方程式表示B-C段发生的反应Ca2++CO32-=CaCO3↓;C点到D点pH增大的原因可用离子方程式表示为CO32-+H2O?HCO3-+OH-.
分析 (1)一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键;相同非金属元素形成的为非极性共价键,不同非金属元素形成的为极性共价键;
(2)质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;N的核电荷数=核外电子总数=7,最外层含有5个电子,据此画出其原子结构示意图;
(3)金属Na、Al、Ca为活泼金属,需要通过电解法冶炼;
(4)离子电子层相同时,核电荷数越大离子半径越小;元素非金属性越强,对应离子的还原性越弱;互为同位素的原子具有相同化学性质;
(5)图示中甲与乙在一定条件下能够相互转化,结合选项中离子性质分析;
(6)由图象可知:BC段pH不变,说明发生反应CaCl2+Na2CO3=CaCO3↓+2NaCl;CD段碱性增强则为碳酸钠过量时,碳酸钠水解引起的,其水解主要以第一步为主.
解答 解:(1)H、C、N、O、Na、Al、A、Cl、Ca元素中形成的既含有离子键又含共价键的离子化合物的化学式有:NaOH、NaClO、Na2O2等;
既含极性共价键又含非极性共价键的共价化合物的化学式有:H2O2、C2H4、N2H4,
故答案为:NaOH(或NaClO、Na2O2等);H2O2(或C2H4、N2H4);
(2)O元素的一种中子数为10的核素的质量数为18,该原子可以表示为:818O,N的核电荷数、核外电子总数都是7,其原子结构示意图为: ,
,
故答案为:818O; ;
;
(3)上述9种元素中的金属有:Na、Al、Ca,它们都是活泼金属,工业上全部采用电解法冶炼,故A正确,
故答案为:A;
(4)N3-、Al3+都含有2个电子层,N3-的核电荷数较小,则离子半径较大,即离子半径:N3-大于Al3+;
非金属性O>S,则对应离子的还原性:O2- 小于S2-;
35Cl 与37Cl互为同位素,二者核外电子排布相同,则具有相同得电子能力,
故答案为:大于;小于;等于;
(5)甲与乙在溶液中的转化关系如右图所示: ,NH3、AlO2-、CO32- 能够满足图示转化关系,只有CH3COO-不与二氧化碳反应,无法从甲转化成乙,故D正确,
,NH3、AlO2-、CO32- 能够满足图示转化关系,只有CH3COO-不与二氧化碳反应,无法从甲转化成乙,故D正确,
故答案为:D;
(6)由图象可知BC段pH不变,则为发生反应CaCl2+Na2CO3=CaCO3↓+2NaCl,其离子方程式为:Ca2++CO32-=CaCO3↓;
CD段碱性增强则为碳酸钠过量时,碳酸钠水解引起的,其水解主要以第一步为主,其水解的离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:Ca2++CO32-=CaCO3↓;CO32-+H2O?HCO3-+OH-.
点评 本题考查较为综合,涉及化学键、极性键与非金属性、离子方程式书写、盐的水解原理、常见化学用语的表示方法等知识,题目难度中等,注意掌握常见化学用语 的书写原则,明确化学键类型及判断方法,试题知识点较多,充分考查了学生的灵活应用能力.

 名校课堂系列答案
名校课堂系列答案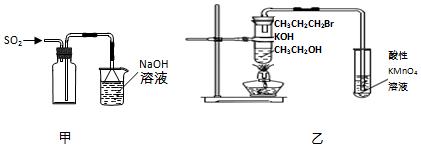
| A. | 用装置甲收集SO2气体 | |
| B. | 用装置乙验证1-溴丙烷发生消去反应是否生成烯烃 | |
| C. | 酸碱中和滴定过程中,眼睛必须注视滴定管刻度的变化 | |
| D. | 配制溶液定容时,俯视容量瓶刻度会使所配溶液的浓度偏高 |
| A. | 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-═Cu(OH)2+SO42-;氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 硝酸银与氯化氢溶液反应:AgNO3+Cl-═AgCl↓+NO3- | |
| D. | 碳酸氢钠溶液与稀硫酸溶液混合:HCO3-+H+=H2O+CO2↑ |
2K3[Fe(C2O4)3]•3H2O→2FeC2O4•2H2O+3K2C2O4+2CO2↑+2H2O
已知:
| 物质名称 | 化学式 | 相对分子质量 | 颜色 | 溶解性 |
| 三草酸合铁(Ⅲ)酸钾 | K3[Fe(C2O4)3]•3H2O | 491 | 翠绿色 | 可溶于水,难溶于乙醇 |
| 草酸亚铁 | FeC2O4•2H2O | 180 | 黄色 | 难溶于水,可溶于酸 |
(一)三草酸合铁(Ⅲ)酸钾的制备
(ⅰ)称取4.50g FeC2O4•2H2O固体,加入饱和K2C2O4溶液中,用滴管慢慢加入3% H2O2溶液,不断搅拌,并保持温度在40℃左右.充分反应后,沉淀转化为氧氧化铁.
(ⅱ)加热至沸腾,滴加1mol 的草酸溶液至沉淀溶解.用草酸或草酸钾调节溶液pH=4-5
(ⅲ)小火加热浓缩,冷却结晶,过滤,先用少量冰水洗涤,再用无水乙醇洗涤,低温干燥后称量,得到9.80g 翠绿色晶体.
(1)完成步骤(i)发生反应的离子方程式:
6FeC2O4•2H2O+6 C2O42-+3 H2O2═2Fe(OH)3+4[Fe(C2O4)3]3-+12H2O
(2)步骤(ⅲ)中,用无水乙醇洗涤晶体的目的是.
(3)列式计算本实验中三草酸合铁(Ⅲ)酸钾的产率.
(二)草酸根含量侧定
准确称取4.80g 三草酸合铁(Ⅲ)酸钾样品,配制成250mL 溶液.量取25.00mL 溶液置于锥形瓶中,加入5.0mL 1mol/L H2SO4,用0.06mol/L的KMnO4溶液滴定.滴定终点时消耗KMnO4溶液20.00mL.
(4)滴定过程中,盛放高锰酸钾溶液的仪器名称是酸式滴定管,滴定时发生反应的离子方程式为5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O或5[Fe(C2O4)3]3-+6MnO4-+48H+=30CO2↑+6Mn2++24H2O+5Fe3+.
(5)样品中草酸根的物质的量为0.03mol;若该数值大于4.80g二草酸合铁(Ⅲ)酸钾纯品中草酸根的物质的量,其原因可能是ac(填字母).
a.制取过程中草酸或草酸钾用量过多
b.样品未完全干燥
c.滴定时盛放KMnO4溶液的仪器未用标准液润洗
d.锥形瓶洗净后未烘干
(三)某同学制得的三草酸合铁(Ⅲ)酸钾,晶体表面发黄,推测可能有部分晶体发生了分解.
(6)为了验证此推测是否正确,可选用的试剂是酸化的K3[Fe(CN)6](铁氰化钾)溶液.
| A. | 2mol氧气与1mol二氧化硫的质量比约为2:1 | |
| B. | 2mol氧气与1mol二氧化硫的体积比约为1:1 | |
| C. | 1mol氧气与3mol二氧化硫的体积比约为1:3 | |
| D. | 1mol氧气与3mol二氧化硫的密度比约为1:3 |
| A. | 镁条燃烧 | B. | 光伏发电 | C. | 光合作用 | D. | 电解冶钠 |
| A. | 电解氯化镁溶液,可制得金属镁 | |
| B. | 测定氢氧化钠是离子化合物时,可将氢氧化钠固体放在石英坩埚中加热熔化 | |
| C. | 向FeCl3溶液中加入Mg粉,可观察到有气泡产生 | |
| D. | 在某钠盐溶液中加入澄清石灰水,若有白色沉淀生成,则该钠盐一定是Na2CO3 |

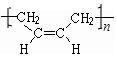 .
.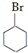 +NaOH$\stackrel{加热}{→}$
+NaOH$\stackrel{加热}{→}$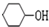 +NaBr.
+NaBr.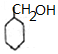 制备的合成路线.
制备的合成路线.