题目内容
19.合成氨原料气由CH4在高温下与水蒸气、空气反应而得.反应原理如下:CH4+2H2O→CO2+4H2 2CH4+O2+2H2O→2CO2+6H2
将反应后的混合气中CO2、H2O (g)通过吸收和干燥除去后,只含N2和H2.为使进入合成氨反应塔两者体积比为1:3.计算起始气体中CH4和空气的比例.(已知空气中O2和N2的体积比为1:4)
分析 N2和H2进入合成氨反应塔两者体积比为1:3,可以设氮气的体积为4x,而氢气的体积为12x,则氧气的体积为x,根据方程式2CH4+O2+2H2O→2CO2+6H2,x体积的氧气生成6x体积的氢气,消耗2x体积的CH4,另外6x体积的氢气由CH4+2H2O→CO2+4H2,消耗CH4为:$\frac{3}{2}$体积,由此分析解答.
解答 解:N2和H2进入合成氨反应塔两者体积比为1:3,可以设氮气的体积为4x,而氢气的体积为12x,则氧气的体积为x,根据方程式2CH4+O2+2H2O→2CO2+6H2,x体积的氧气生成6x体积的氢气,消耗2x体积的CH4,另外6x体积的氢气由CH4+2H2O→CO2+4H2,消耗CH4为:$\frac{3}{2}$x体积,起始气体中CH4和空气的比例为:(2x+$\frac{3}{2}$x):5x=7:10,
答:起始气体中CH4和空气的比例为7:10.
点评 本题侧重考查学生的分析思维能力与解题方法技巧,本题题目难度中等.

练习册系列答案
相关题目
20.用惰性电极电解CuSO4溶液一段时间后,停止电解,向所得溶液中加入0.1molCu2(OH)2CO3,溶液浓度恢复至电解前,关于该电解过程的说法不正确的是( )
| A. | 生成Cu的物质的量是0.2mol | B. | 转移电子的物质的量是0.4mol | ||
| C. | 随着电解的进行溶液的pH减小 | D. | 阳极反应是2H2O-4e-=4H++O2↑ |
14.下列过程光能变为电能的是( )
| A. | 镁条燃烧 | B. | 光伏发电 | C. | 光合作用 | D. | 电解冶钠 |
8.下列仪器:①烧杯②坩埚③锥形瓶④蒸发皿⑤试管⑥烧瓶⑦表面皿,用酒精灯加热时,不需要垫石棉网的是( )
| A. | ②④⑤ | B. | ②④⑦ | C. | ④⑥⑦ | D. | ①③⑥ |
9.有一种“水”电池,在海水中电池总反应可表示为行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
| A. | 正极反应式:Ag+Cl--e-=AgCl | |
| B. | Na+不断向“水”电池的负极移动 | |
| C. | 每生成1molNa2Mn5O10转移2mol电子 | |
| D. | AgCl是还原产物 |

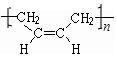 .
.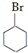 +NaOH$\stackrel{加热}{→}$
+NaOH$\stackrel{加热}{→}$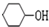 +NaBr.
+NaBr.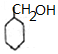 制备的合成路线.
制备的合成路线.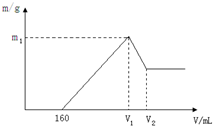 将镁和铝的混合物0.1mol溶于100ml 2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答:
将镁和铝的混合物0.1mol溶于100ml 2mol/L的H2SO4溶液中,然后滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示,请回答: